 三甲
三甲
中国透析患者慢性心力衰竭管理指南
【摘要】心力衰竭(heart failure)是透析(dialysis)患者的第二大心血管疾病。透析患者一旦合并心力衰竭,生存率显著下降。尽管国内外已颁布了多部普通人群心力衰竭相关的临床指南或专家共识,但由于透析患者肾功能极差甚至没有残余肾功能、慢性并发症多,加上血液透析(hemodialysis,HD)和腹膜透析(peritoneal dialysis,PD)治疗本身的特殊性、可变性及局限性,使透析患者与普通人群在心力衰竭诊断、治疗及管理等方面均存在很大的不同。故而现有国内外指南和共识并不完全适用于透析人群,迫切需要透析患者心力衰竭管理的指导性文件,以指导、规范心力衰竭的诊疗。鉴于此,中华医学会肾脏病学分会和中关村肾病血液净化创新联盟组织专家组制定了这部《中国透析患者慢性心力衰竭管理指南》。该指南基于循证医学证据及临床经验,就心力衰竭诊断、危险因素管理、 HD管理、 PD管理、药物管理及其他管理等问题做了系统的介绍,反映了当今透析患者心力衰竭诊疗的新观点及未来发展趋势,有利于进一步加强临床医生对透析患者心力衰竭的认识、规范透析患者心力衰竭的临床管理流程,对改善透析患者预后具有重要价值。
【关键词】 透析;心力衰竭;疾病管理;指南
DOI: 10.3760/cma.j.cn441217-20210812-00068
本文引用:中华医学会肾脏病学分会, 中关村肾病血液净化创新联盟. 中国透析患者慢性心力衰竭管理指南[J]. 中华肾脏病杂志, 2022, 38(5): 465-496. DOI: 10.3760/cma.j.cn441217-20210812-00068.
Chinese Society of Nephrology, Zhongguancun Nephrology & Blood Purification Innovation Alliance. Guidelines for the management of chronic heart failure in dialysis patients in China[J]. Chinese Journal of Nephrology, 2022, 38(5): 465-496. DOI: 10.3760/cma.j.cn441217-20210812-00068.
概述
流行病学研究显示,2017年全球慢性肾脏病(chronic kidney disease,CKD)患者达 6.975亿例,全球患病率为9.1%,终末期肾病(end-stage renal disease,ESRD)患病率为0.07%[1]。从 1990年到 2017年, CKD全球全年龄段死亡率增加了41.5%,其中心血管疾病(cardiovascular disease, CVD)是此类患者的首要死亡原因[1]。2017年因 CKD或肾功受损引起的 CVD,占全球 CVD死亡人数的7.6%[1];我国调查显示超过 50%的透析患者死于 CVD[2]。心力衰竭是我国透析患者第二常见的 CVD,占所有 CVD的10.2%[3]。透析患者一旦合并心力衰竭,生存率明显下降。
心力衰竭是多种原因导致心脏结构和 /或功能改变,从而引起心室收缩和 /或舒张功能障碍的一组临床综合征。美国肾脏病数据系统(United States Renal Data System,USRDS)报告显示,随着肾功能的恶化,心力衰竭患病率不断增高,在透析患者中心力衰竭患病率约为 40%[4-5];我国的一项研究显示, 2005—2010年间中国透析患者的心力衰竭总体患病率为 44%[6]。此外,不同透析模式下,心力衰竭患病率亦有所不同。在美国,血液透析(hemodialysis,HD)患者的心力衰竭患病率明显高于腹膜透析(peritoneal dialysis,PD)患者(40.3%比 23.3%)[5],而中国 PD患者的心力衰竭患病率略高于 HD患者(47.3%比42.9%)[6]。
心力衰竭与 ESRD常常互相影响、互相促进,导致患者预后进一步恶化。USRDS数据显示,未伴有心力衰竭的透析患者 2年死亡率约 16.5%,而伴有心力衰竭的患者 2年死亡率高达 33.3%[5]。另外,伴有心力衰竭的透析患者住院风险[7]和治疗费用 [8]均显著增加。
尽管我国心血管领域的专家制定了《中国心力衰竭诊断和治疗指南 2018》[9],但透析患者肾功能极差甚至没有残余肾功能,且慢性并发症多,加之 HD和 PD本身的特殊性、可变性及局限性,使得透析患者的心力衰竭与普通人群的心力衰竭在诊断、治疗及心力衰竭危险因素的管理方面存在很大的不同,目前国际上也缺乏透析患者慢性心力衰竭管理的指南或共识,因此,迫切需要制定透析患者心力衰竭管理指南,以规范心力衰竭的诊疗。
中华医学会肾脏病学分会和中关村肾病血液净化创新联盟组织专家基于循证医学证据及临床经验制定了本部透析患者慢性心力衰竭管理指南。指南编写工作组通过对相关领域文献进行系统全面的检索、数据分析及专业讨论,就心力衰竭诊断、危险因素管理、 HD管理、 PD管理、药物管理及其他管理等问题进行了系统性的阐述。该指南的制定有利于规范透析患者心力衰竭的临床管理流程,改善患者预后。
参考欧洲心脏病学会 CVD临床实践指南等国际指南,在本指南编写过程中,推荐程度分级严格遵循以下原则:Ⅰ:已证实和 /或一致公认有效,专家组有统一认识;Ⅱa:有关证据 /观点倾向于有用或有效,应用这些操作或治疗是合理的,专家组意见基本一致;Ⅱb:有关证据 /观点尚不能被充分证明有用或有效,但可以考虑使用,专家组有一定争议;Ⅲ:已证实和 /或公认无用或无效,不推荐使用。证据质量分级采用以下原则:A:数据来源于多中心随机对照试验(randomized controlled trial,RCT)、 Meta分析或大型注册数据库;B:数据来源于单个 RCT或设计良好的非随机研究;C:数据仅来源于专家共识或病例报告。
透析患者心力衰竭的诊断
一、心力衰竭的分类
心力衰竭是一组复杂的临床综合征,主要表现为呼吸困难、疲乏和液体潴留(肺淤血、体循环淤血及外周水肿)等,分类方式见表1[10]。考虑到以左心室射血分数(left ventricular ejection fraction,LVEF)水平为依据的分类方式在临床中的便捷性和可及性,在本指南的后续内容中我们主要基于此种分类方式进行阐述。

二、心力衰竭的分级
目前心力衰竭严重程度分级通常采用美国纽约心脏病学会(New York heart association,NYHA)分级标准,以诱发心力衰竭症状的运动量为主要依据 [11],见表 2。

然而,鉴于透析患者受透析治疗因素的影响,透析间期呼吸困难不能仅归因于心力衰竭,且其严重程度随容量的减少而改变,因此将 NYHA分级标准应用于此类患者存在一定局限性。为了弥补这一问题,急性透析质量倡议(Acute Dialysis Quality Initiative,ADQI)工作组[12]提出了针对透析患者的心力衰竭分级,考虑了透析患者心力衰竭症状的评估时间和透析周期性,见表 3。

三、心力衰竭的诊断
心力衰竭的诊断和评估依赖于病史、体格检查、实验室检查、心脏影像学和功能检查。临床上首先通过病史及体格检查识别可疑心力衰竭患者,继而检测利尿钠肽和超声心动图明确是否存在心力衰竭(诊断标准见表 4)[9],再进一步确定心力衰竭的病因和诱因,最后还需评估病情的严重程度及预后,以及是否存在并发症及合并症。

值得注意的是,在透析患者中,辅助影像学和实验室检查(例如心电图、胸部 X线片)表现往往缺乏特异性;传统的生物标志物,如N末端B型利尿钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)和高敏肌钙蛋白T(high-sensitivity troponin T,hs-TnT),其血液浓度受肾脏排泄量降低的影响,故其标准可能异于一般人群[13],但目前在透析人群尚无公认的临界值,其应用仍存在争议。因此,专家组建议,心力衰竭的诊断仍是基于有特征性症状和体征以及心脏结构或功能异常的证据。
(一)症状和体征
心力衰竭是一种基于特征病史和体格检查的临床诊断,是以肺循环和 /或体循环淤血、器官和组织血液灌注不足为临床表现的一组综合征,主要表现为呼吸困难、乏力以及液体潴留;特征性体征包括:湿啰音、外周水肿、颈静脉充盈、肝颈静脉回流征、心尖搏动位置改变、第三心音奔马律以及心脏杂音等。
然而,这些症状和体征也可在透析患者中见到,临床上很难将心力衰竭与全身容量超负荷区分开来。因此,透析患者的早期心力衰竭症状常常被遗漏。
推荐意见
1. 对透析患者加强心力衰竭相关症状与体征的监测,尤其注意将其与全身容量超负荷相鉴别。(推荐程度Ⅰ,证据质量C)
(二)常规检查
1. 心电图:大部分心力衰竭患者存在心电图异常,因此所有心力衰竭以及怀疑心力衰竭患者均应行心电图检查,明确心律、心率、QRS形态、QRS宽度等。心电图检查不仅有助于心力衰竭的诊断,而且有利于确定心力衰竭病因以及制定治疗计划[14]。然而,约 10%~15%的慢性心力衰竭患者在休息时心电图是正常的,因此行心电图检查评价心力衰竭存在局限性[15]。对于怀疑存在心律失常但无症状性心肌缺血的患者,应行 24 h动态心电图。
推荐意见
2. 对于疑似心力衰竭或新诊断心力衰竭的透析患者,推荐行心电图检查,以评估心律、心率、 QRS波形态与时限,并明确是否存在心肌缺血或左心室肥厚等潜在疾病。(推荐程度Ⅰ,证据质量B)
2. 胸部X线片:为识别 /排除肺部疾病或其他引起呼吸困难的疾病,提供肺淤血 /水肿和心脏增大的信息,应行胸部 X线检查,但胸部 X线片正常并不能除外心力衰竭。
推荐意见
3. 对于疑似心力衰竭或新诊断心力衰竭的透析患者,推荐行胸部 X线检查,以发现肺淤血 /水肿及心脏增大的迹象,并识别可能导致患者症状的其他心脏或非心脏原因。(推荐程度Ⅰ,证据质量B)
3.生物标志物:
(1)利尿钠肽(BNP或 NT-proBNP):在一般人群中,利尿钠肽尤其是BNP已应用于心力衰竭的筛查、诊断和鉴别诊断、病情严重程度及预后评估。一系列高质量研究支持了利尿钠肽在诊断心力衰竭方面的价值[16-20],现有证据表明,利尿钠肽非常适合用于排除心力衰竭的诊断,但不能独立于体征、症状和其他诊断信息使用[21]。在一般人群中,BNP<35 ng/L、NT-proBNP<125 ng/L时通常可排除慢性心力衰竭[9]。然而,在透析患者中,利尿钠肽的水平可能受以下因素影响:首先,随着肾小球滤过率(glomerular filtration rate,GFR)降低,其清除率下降[22];其次,BNP会随着心肌壁舒张的增加而分泌,其测量值取决于容量状态;第三,透析可部分清除利尿钠肽,其清除水平与透析膜材料及透析时间相关[23]。目前学术界认为,在透析患者中,BNP水平升高仍可反映心力衰竭的存在及严重程度并提供预后信息,但需根据肾功能调整诊断临界值。Jafri等[24]在探讨肾功能不全患者BNP与NT-proBNP诊断HFrEF临界值的横断面研究中认为,肾功能不全时 BNP、NT-proBNP升高,肾功能不全程度加剧时应使用更高的临界值,且NT-proBNP比BNP更能预测心力衰竭;此外,亦考虑到NT-proBNP半衰期(60~90 min)长于 BNP(20 min),且前者在血浆中的浓度也高于后者,更便于临床检测[25]。因此,我们建议以NT-proBNP作为评估透析患者心力衰竭的指标。《中国心力衰竭诊断和治疗指南 2018》[9]中对肾功能不全(GFR<60 ml/min)患者心力衰竭诊断中建议将NT-proBNP>1200 ng/L作为诊断界值,但是具体并未进一步阐明。Jafri等[24]进行的横断面研究显示,ESRD患者NT-proBNP的最佳临界值为 11215.2 ng/L(受试者工作特性曲线下面积 1,敏感度 94.7%,特异性 100.0%),这一结果可为诊断ESRD患者心力衰竭的NT-proBNP临界值提供参考,但由于这一研究样本量较少且主要纳入的患者为HFrEF患者,故这一标准的准确性和有效性(尤其是在HFpEF和HFmrEF患者中)需在独立的前瞻性研究中和临床实践中加以证实。
推荐意见
4. 建议对疑似心力衰竭或新诊断心力衰竭的透析患者进行利尿钠肽检测,用于心力衰竭的早期诊断或排除。(推荐程度Ⅰ,证据质量B)
5. 建议以达到干体重时的NT-proBNP作为透析患者心力衰竭诊断的主要生物标志物。(推荐程度Ⅱa,证据质量C)
(2)心脏肌钙蛋白(cardiac troponin,cTn):外周血 cTn升高可反映心肌损伤,虽一般不用于心力衰竭的初步诊断,但无论在一般人群还是透析人群中,都对心力衰竭的病因诊断、危险分层以及预后评估有重要意义[26-28]。在 cTn中,肌钙蛋白 T(TnT)较肌钙蛋白 I(TnI)对预后的预测价值更高,且由于 hs-TnT敏感性高于 TnT,故应用更为广泛[29]。hs-TnT随肾功能不全进展而有轻度升高,需根据肾功能调整预后评估临界值。一项纳入了 10项研究的 Meta分析[30]显示, CKD 4~5期患者中 hs-TnT预测全因死亡率的最佳临界值为 40 ng/L(受试者工作特性曲线下面积 0.66,敏感度 59%,特异性 65%)。
推荐意见
6. 建议对疑似心力衰竭或新诊断心力衰竭的透析患者进行 hs-TnT检测,以协助心力衰竭的病因诊断、危险分层以及预后评估。(推荐程度Ⅰ,证据质量A)
(3)反映心肌纤维化、炎症、氧化应激的标志物:①可溶性生长刺激表达基因 2蛋白(soluble growth stimulation expressed gene 2,sST2):sST2是反映心肌细胞功能障碍和组织纤维化程度的生物标志物,其水平不受 GFR的影响[31],且 HD前后浓度变化不大(低通量 HD后+2%,高通量 HD后+3%)[32]。因此,血清 sST2在透析心力衰竭患者中仍具有很强的诊断和预后评估价值,且不需要调整临界值[32],是目前透析人群中最有潜力的生物标志物,其与 BNP联合诊断的准确性更高[33]。值得注意的是, sST2在炎症、癌症、糖尿病中水平升高,故在临床应用时必须考虑这些混杂因素。②半乳糖凝集素 3(galectin-3,Gal-3):Gal-3是反映组织炎症及纤维化的指标,其外周血水平随着 GFR降低而升高。血清 Gal-3对包括 ESRD患者在内的 CKD患者的心力衰竭预后评估有重要意义[34-35],但其在诊断和指导治疗中的作用尚未得到证实。
此外,联合使用多种生物标志物有利于更准确地评估心力衰竭,也是未来的发展方向。同时,亦有多项研究探索新型标志物在肾脏疾病中的预测价值,未来可能有助于透析患者心力衰竭的诊断[36-38]。
推荐意见
7. 对于透析心力衰竭患者,可考虑进行心脏损伤或纤维化生物标志物检测,以协助心力衰竭的危险分层和预后评估。(推荐程度Ⅱb,证据质量C)
(4)超声心动图:超声心动图是诊断心力衰竭的重要检查,也是评估心脏结构和功能的首选检查,可提供房室容积、室壁厚度、左右心室收缩和舒张功能、心内充盈压力、瓣膜结构和功能、肺动脉压和心包疾病等信息,不仅有助于提高心力衰竭诊断的准确性,还能辅助进行分型以指导管理。在透析患者中,应着重关注的超声心动图指标包括:左心室尺寸和壁厚(用以评估是否存在左心室肥大及几何结构)、LVEF、左心室舒张功能、瓣膜外观及功能、左心房压力和肺动脉收缩压。2014年 ADQI工作组[12]提出了针对透析人群的心力衰竭超声心动图诊断标准,共包含 8项指标(见表 5),如患者满足至少 1项指标且排除了肺部疾病引起的呼吸困难,则可被诊断为心力衰竭。

推荐意见
8. 推荐对所有疑似或新诊断心力衰竭的透析患者进行超声心动图检查,以评估心脏结构和功能,提高诊断准确性并协助分型,从而指导管理。(推荐程度Ⅰ,证据质量B)
然而,在透析人群中,约有75%存在左心室肥大(left ventricular hypertrophy,LVH)[39]且因左心室僵硬度增加而对容量变化的反应存在夸大的血流动力学变化 [40],在临床实践中很难将舒张功能障碍与继发于透析患者的单纯性容量超负荷区分开来,因此这一诊断标准的特异性受到了质疑。梅奥诊所针对 HD开始前 1个月及 HD后 3个月患者的回顾性研究显示,符合 ADQI标准 1项及以上的患者占 87%,符合 3项及以上的患者占 54%,但这些异常表现对患者预后的预测价值有限[41]。对此,专家组认为,可考虑使用 ADQI心力衰竭的超声心动图诊断标准,但应注意其可能引起的过度诊断问题。另外,考虑到容量因素对透析患者超声心动图检测结果的影响,专家组建议在患者达到干体重时进行超声心动图检测。
由于透析人群罹患心力衰竭的风险较高, 2005年美国肾脏基金会 /肾脏疾病预后质量倡议工作组关于透析患者 CVD的临床实践指南 [42]建议,一旦患者达到干体重,理想情况是在开始透析的 1~3个月内进行评估,此后每 3年评估一次,或者患者的临床状况发生变化时评估。对已经诊断为心力衰竭的患者,采用超声心动图定期随访有助于降低与心力衰竭相关的病死率、发病率和住院率。但目前关于透析患者心力衰竭随访的最佳频率暂缺乏大规模前瞻性临床试验证实,故暂不做建议。对于那些存在心力衰竭症状或体征恶化的患者,应根据临床需要进行超声心动图随访评估。
推荐意见
9. 建议在透析患者达到干体重时行超声心动图检查以排除容量因素对检查结果的影响。(推荐程度Ⅱa,证据质量C)
10. 在透析患者中,可考虑使用 ADQI工作组心力衰竭的超声心动图诊断标准,但应注意其可能引起的过度诊断问题。(推荐程度Ⅱb,证据质量C)
11. 对存在心力衰竭症状或体征恶化的透析患者,应根据临床需要进行超声心动图随访评估,以降低与心力衰竭相关的病死率、发病率和住院率。(推荐程度Ⅱa,证据质量B)
(5)实验室检查:血常规、血清钠、钾、葡萄糖、尿素氮、肌酐、估算 GFR(eGFR)、钙、磷、肝酶、胆红素、血清铁、铁蛋白、总铁结合力、血脂、糖化血红蛋白、促甲状腺素、甲状旁腺素为心力衰竭患者的初始常规实验室检查内容。
(三)特殊检查
心力衰竭的特殊检查适用于需要进一步明确病因和病情评估的患者。
1. 心脏磁共振(cardiac magnetic resonance,CMR):CMR是测量左右心室容量、质量和射血分数的“金标准”,当超声心动图未能做出诊断时, CMR可用于评估 LVEF和左心室容积。此外,钆增强 CMR可帮助明确病因,区分缺血性和非缺血性心脏病引起的心力衰竭;对于缺血性心肌病,延迟钆增强 CMR可能通过透壁测量评估心肌存活能力从而判断血运重建的适应证,有助于改善心力衰竭患者的预后和症状[43-44]。但由于钆可能造成肾源性全身性纤维化,故而钆增强在透析人群的使用受到限制。改善全球肾脏病预后组织(KDIGO)指南[45]建议,避免在透析人群中使用钆增强剂,除非必须依靠其提供诊断信息。专家组基于临床经验认为,透析患者如需 CMR增强扫描,可考虑采用非钆成像;对于必须使用钆增强的 HD患者,在下一次 HD前进行并在 24 h后追加一次 HD以最大限度清除钆;由于大部分含钆造影剂分子量大于 500道尔顿,高通量 HD可能更有利于钆造影剂的清除;对于 PD患者,由于 PD对钆的清除率较低,建议检查后给予 HD治疗;对于即将进入透析的 ESRD患者,将钆增强检查放在血管通路建立之后可能更为合理[46]。目前在透析患者中基于非钆的 CMR的验证为心力衰竭诊断提供了新的可能性[47-48]。
推荐意见
12. 在初步的临床评估(包括心电图和超声心动图)后仍无法明确心力衰竭诊断,或是需进一步明确病因(如低中度冠心病风险需区分缺血性或非缺血性心室功能障碍、明确是否有心肌炎等),或是需判断冠状动脉血运重建适应证的透析患者可考虑行 CMR,如需增强扫描可考虑采用非钆成像。(推荐程度Ⅱb,证据质量C)
13. 如使用钆增强的 CMR,建议检查后尽快行高通量 HD治疗并于 24 h后增加一次高通量 HD以最大限度清除钆,减轻肾源性全身纤维化风险。(推荐程度Ⅱa,证据质量C)
2. 心脏CT:心脏 CT可以准确评估心脏(包括冠状动脉)的结构和功能,与超声心动图相比, CT更能反映心肌特征;CT血管造影(CT angiography,CTA)在发现及排除冠状动脉狭窄方面具有良好的敏感性和特异性,其阳性预测价值适中、阴性预测价值较高(>98%)[49]。透析人群中 CT/CTA应用的数据有限。一项纳入 70例 HD患者的研究显示, CTA在诊断和预后评估方面具有较高价值,为其在透析患者中的应用提供了支持[50]。但需重视的是,心脏 CT/CTA在透析患者中的应用可能存在以下限制:(1)透析患者高发的血管钙化可能影响结果的准确性,因为很难区分高密度的钙化影和管腔中的造影剂影;(2)CT无法区分中膜与内膜钙化;(3)含碘造影剂可能损伤患者的残余肾功能并可能引起容量超负荷及高钾,因此需加强容量状态评估及血钾监测。
推荐意见
14. 对于低中度可疑的冠心病或负荷试验未能明确诊断心肌缺血的透析心力衰竭患者,可行心脏 CT/CTA以排除冠状动脉狭窄,但应注意钙化对其准确性的影响,以及含碘造影剂对患者残余肾功能、容量负荷及血钾的影响。(推荐程度Ⅱa,证据质量B)
3. 冠状动脉造影:冠状动脉造影是发现或排除缺血性心脏病的“金指标”,有利于明确心力衰竭病因。目前观点认为,包括 ESRD在内的 CKD人群接受冠状动脉造影的指征与一般人群类似。因此,专家组建议,对于有冠心病危险因素(包括糖尿病、既往 CVD、透析龄>1年、左心室肥厚、年龄>60岁、吸烟、高血压、血脂异常)、无创检查提示存在心肌缺血的透析心力衰竭患者,可考虑进行冠状动脉造影检查,但要注意造影剂对残余肾功能、容量负荷及血钾的影响[46]。
推荐意见
15. 对于有冠心病危险因素、无创检查提示存在心肌缺血的透析心力衰竭患者,可考虑行冠状动脉造影检查,但要注意含碘造影剂对残余肾功能、容量负荷及血钾的影响。(推荐程度Ⅱb,证据质量C)
4. 生活质量评估:生活质量评估指运用心理学量表对心理健康、躯体健康和社会功能等进行多维度量化评估。生活质量量表可分为普适性量表和疾病特异性量表,前者最常使用的是 36条简明健康问卷(SF-36)及简版 SF-12、世界卫生组织幸福指数-5、欧洲 5维健康指数。心力衰竭特异性生活质量评估工具中较常使用的有明尼苏达心力衰竭生活质量量表和堪萨斯城心肌病患者生活质量量表(KCCQ),其中, KCCQ已在一些研究中被证明比其他生活质量评估工具更能有效反映心力衰竭患者的临床变化[51]。CRIC研究显示,在 3093例未被临床诊断为心力衰竭的 CKD患者中,有 25%被修订后的 KCCQ评分证实存在明确的心力衰竭症状[52]。这一结果表明,KCCQ可能会在 CKD人群中发现亚临床性心力衰竭,有望用于心力衰竭筛查。但这一研究并未纳入透析患者,故而 KCCQ在透析人群中的效力仍需进一步研究证实。因此,专家组建议,对于透析心力衰竭高危患者,可考虑应用生活质量评估以帮助筛查亚临床性心力衰竭。
推荐意见
16. 生活质量评估有助于亚临床性心力衰竭的筛查,可考虑应用于透析心力衰竭高危患者。(推荐程度Ⅱb,证据质量C)
5. 其他:
(1)负荷超声心动图:运动或药物负荷超声心动图可用于心肌缺血和 /或存活心肌、部分瓣膜性心脏病患者的评估。对存在劳力性呼吸困难、 LVEF正常但静息舒张功能参数未能做出诊断的患者,负荷超声心动图有一定辅助作用。
(2)核素心室造影及核素心肌灌注和 /或代谢显像:当超声心动图不能明确诊断时,可使用核素心室造影评估左心室容量和 LVEF。
(3)有创血流动力学检查:在慢性心力衰竭患者中右心导管和肺动脉导管检查适用于:考虑心脏移植或机械循环支持的重症心力衰竭患者的术前评估;超声心动图提示肺动脉高压的患者,在瓣膜性或结构性心脏病干预治疗前评估肺动脉高压及其可逆性;对经规范治疗后仍存在严重症状或血流动力学状态不稳定的患者,为调整治疗方案可考虑行此检查。
(4)心肺运动试验和 6 min步行试验:心肺运动试验能量化运动能力;6 min步行试验用于评估患者的运动耐力。
(5)心肌活检:对特殊病因的心力衰竭,可以进行心肌活检,但不推荐用于心力衰竭的常规评估。
(四) HFpEF与透析患者
在透析患者中,最常见的心力衰竭类型是 HFpEF,约有 20%的 HD患者和 10%~20%的 PD患者伴有 HFpEF[53]。一项前瞻性队列研究显示,在伴有心力衰竭的 HD患者中, 81%为 HFpEF[54]。来自中国香港的一项前瞻性研究也显示,在伴有心力衰竭的 PD患者中, HFpEF约占 55%[55]。
推荐意见
17. HFpEF是透析患者最常见的心力衰竭类型,故而对 EF≥50%的患者,应加强对心室舒张功能的评估。(推荐程度Ⅰ,证据质量B)
HFpEF主要表现为左心室舒张功能障碍。在临床症状和体征提示可疑心力衰竭后,超声心动图是明确左心室舒张功能的首选检查。根据美国超声心动图学会和欧洲心血管影像协会对评估左心室舒张功能的新建议,有 5个变量可识别左心室舒张期功能障碍(如图 1所示),如果超过一半的可用参数符合诊断标准,则可认为存在左心室舒张期功能障碍[56]。2020年《舒张性心力衰竭诊断和治疗专家共识》推荐,对左心室舒张功能异常的患者进一步评估二尖瓣 E/A比值,以进行左心室舒张功能分级[57]。但是,必须注意的是,舒张期功能障碍的超声心动图评估取决于二尖瓣瓣口血流、环形组织多普勒、左心房容积和肺静脉血流量,而这些均依赖于容积变量[58]。由于透析患者存在容量超负荷的情况,超声心动图的准确性可能受到影响。因此,建议在患者达到干体重时进行超声心动图检查,并对结果仔细判读。除超声心动图参数外,舒 张期功能障碍的客观证据还应包括心电图(左心室肥厚、左心房扩大、房颤等)、胸部 X线片(心脏增大及肺淤血/水肿)以及心脏生物标志物如利尿钠肽[59] 。升高的利尿钠肽水平已被多部共识 /指南推荐作为 HFpEF的附加诊断标准[60-62] ,但其水平可能低于 HFrEF中的应用标准[62] 。目前 HFpEF透析患者中利尿钠肽的合理临界值尚缺乏研究。此外,右心导管检查也是诊断 HFpEF的重要依据,其标准为肺毛细血管楔压(pulmonary capillary wedge pressure,PCWP)>15 mmHg(静息)和 PCWP>25 mmHg(运动)[57] 。
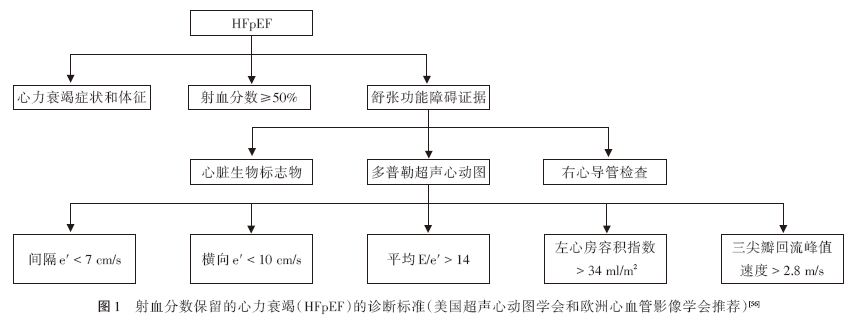
透析患者心力衰竭管理
一、透析患者心力衰竭的危险因素及管理
许多因素可导致透析患者心脏结构异常,如 LVH或心脏舒缩功能异常,并进一步促进心力衰竭的发生与发展。这些因素包括与普通人群相似的传统危险因素及与 ESRD相关的危险因素,早期识别这些危险因素对于透析心力衰竭患者具有重要意义。
(一)传统危险因素及管理
1. 高血压及管理:高血压导致心脏后负荷增加,促进 LVH的发生,进而引起心脏舒张功能障碍,导致左心室充盈压力升高及舒张性心力衰竭;随着疾病进展,部分患者将最终发展为收缩期心脏功能障碍[63]。透析患者中高血 压患病率高达90%[64-65] 。一项针对透析患者的观察性研究显示,平均动脉血压与向心性 LVH、左心室扩张、左心室容积、左心室质量指数等指标显著相关,是心力衰竭的独立危险因素[66] 。
成人高血压患者初步降压目标为 140/90 mmHg,对于能够耐受和部分高危患者进一步降至 130/80 mmHg或更低 [67],对 CVD高危人群,强化降压(收缩压目标值<120 mmHg)者主要心血管事件发生率和全因死亡率更低[68]。肾功能不全患者的降压目标仍存在争议,收缩期血压干预试验(Systolic Blood Pressure Intervention Trial,SPRINT)研究 CKD亚组 [eGFR 20~59 ml·min-1·(1.73 m2)-1]分析结果显示,与收缩压<140 mmHg相比,收缩压<120 mmHg的患者心血管事件发生率及全因死亡率更低[69],肾脏疾病的饮食调整(Modification of Diet in Renal Disease,MDRD)及非裔美国人肾脏疾病研究(African American Study on Kidney Disease,AASK)的联合队列分析亦证实了这一观点[70]。
目前仍缺乏针对透析患者降压目标的研究。2005年 KDOQI指南[42]建议 HD患者透析前血压控制在 140/90 mmHg以下,透析后控制在 130/80 mmHg以下,但由于证据级别有限,2012年 KDIGO的 CKD血压管理指南及 ACC/AHA指南并未沿用这一建议。2015年《中国血液透析充分性临床实践指南》结合我国实际情况提出 HD患者透析前收缩压<160 mmHg[71],《中国肾性高血压管理指南 2016(简版)》[72]亦建议以此作为维持性 HD患者的血压控制目标值。《中国高血压防治指南(2018年修订版)》[73]则指出,透析前或诊室测量的血压并不能很好地反映透析患者的平均血压,推荐患者家庭测量血压,透析患者血压变异不宜过大,透析后 SBP的理想靶目标为 120~140 mmHg。参照 2015年国际腹膜透析协会(International Society for Peritoneal Dialysis,ISPD)成人 PD患者心血管及新陈代谢指南[74],建议 PD患者血压控制在140/90 mmHg以下。
现有研究缺乏对透析心力衰竭患者血压控制靶目标的建议。专家组建议,HD患者透析前血压控制在140/90 mmHg以下,透析后控制在130/80 mmHg以下,PD患者血压控制在140/90 mmHg以下。
推荐意见
18. 建议HD患者透析前血压控制在140/90 mmHg以下,透析后控制在130/80 mmHg以下。(推荐程度Ⅱa,证据质量C)
19. 建议PD患者血压控制在140/90 mmHg以下。(推荐程度Ⅱa,证据质量C)
钙通道阻滞剂(calcium channel blocker,CCB)、血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)、血管紧张素Ⅱ受体阻滞剂(angiotensin Ⅱ receptor blocker,ARB)、 α受体阻滞剂、 β受体阻滞剂、利尿剂都是透析患者可选的降压药物,可根据患者具体情况如残余肾功能、血钾水平、容量负荷、心功能等个体化选择,常需联合用药,使用 ACEI/ARB时应监测血钾水平 [75]。近来,越来越多的研究显示,血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI)可有效改善一般人群的血压控制 [76-78],并于 2021年 6月在中国获批适用于高血压,近来这一药物在透析人群中的降压效果在一项单中心、前瞻性、前后对照试验中得以证实 [79],而其对心脏、肾脏等靶器官的多重保护作用可能使其成为透析患者未来血压控制的新选择。
2. 便秘及管理:活动量减少、脱水治疗、肠道菌群改变、药物等因素会导致便秘,而排便困难会引起血压升高,诱发心力衰竭[80-81]。便秘是透析患者最常见的胃肠道症状之一,1.6%~71.7%的HD患者、14.2%~90.3%的 PD患者有便秘表现[82]。早期识别便秘的病因、病理生理过程和/或引起便秘的症状因素是管理便秘的关键[83],便秘的非药物干预措施包括适当增加体力活动、适当增加膳食纤维[81]。包括透析患者在内的 CKD患者适当增加植物性的、富含纤维的食物可降低死亡风险[84],但透析患者需警惕含钾食物摄入增加引起高钾血症[82]。添加益生元、益生菌亦可能有助于治疗 CKD患者便秘[81]。对于非药物干预后效果欠佳者,可应用排便药物,可参考慢性特发性便秘用药[85],目前缺乏 CKD患者便秘管理指南。乳果糖[86]、利那洛肽[87]、鲁比前列酮[88]因其保护肾脏、减少尿毒症毒素蓄积、改善肠道菌群及微环境的特性,值得特别关注[81]。此外,肠道菌群移植也是未来的研究热点。
推荐意见
20. 推荐在透析患者膳食中适当增加富含纤维的食物。(推荐程度Ⅱa,证据质量A)
3. 其他传统危险因素及管理:高龄、吸烟、酗酒、肥胖、糖尿病、脂代谢紊乱[89-91]等是发生心力衰竭等心血管事件的传统危险因素,其中部分因素在透析患者中的患病率更高[92]。
戒酒、控制体重[93-94]可能有助于预防或延缓心力衰竭的发生。对血脂异常的管理,应与生活方式干预相结合,根据风险评估模型,对需要接受他汀类药物治疗的患者给予中等强度或高强度的他汀类药物治疗[95-96]。依据《中国 2型糖尿病防治指南(2017年版)》[97],对于血糖的管理,应重视糖尿病的教育,生活方式的干预是基础治疗措施。透析患者宜优选从肾脏排泄较少的降糖药,严重肾功能不全患者宜采用胰岛素治疗。
(二) ESRD相关危险因素及管理
1. 容量超负荷:尿量减少、干体重计算不当、水盐摄入过多等因素引起透析患者水钠潴留、慢性容量超负荷,致心脏前负荷增加,亦是透析患者心力衰竭发生的主要危险因素[98]。容量负荷过重,心室舒张末容积增加,心室肌纤维被拉伸,早期可通过 Frank-Starling机制代偿,但慢性高容量负荷将发生心肌失代偿,最终将转变为心力衰竭,其可能机制包括心肌细胞凋亡增加、肌联蛋白低磷酸化作用导致心肌顺应性降低等 [99]。研究显示,HD患者增加超滤、限制盐的摄入可改善左心室容积及LVH[100-101]。推荐按照透析管理相关章节进行容量管理。
2. 尿毒症毒素:蓄积在透析患者体内的多种尿毒症毒素可通过影响白细胞[102]、内皮细胞[103-104]、平滑肌细胞[105-106]等多种细胞功能,影响心肌细胞功能、诱发血管病变,促进动脉粥样硬化发生[102]、炎症发展[107]或血栓形成[105-106],导致透析患者心血管事件风险增加。多种肠道菌群来源的尿毒症毒素与心力衰竭关系密切:血浆硫酸吲哚酚(indoxyl sulfate,IS)水平与 HD患者首次心力衰竭事件风险显著相关[108];心力衰竭患者血浆 IS及氧化三甲胺(trimethylamine N-oxide,TMAO)显著高于正常对照[109],动物实验显示其机制可能为 TMAO可促进左心室扩大、心肌纤维化、心室重塑、心肌肥厚[110]。但上述尿毒症毒素在透析患者中的观察研究尚缺少。推荐按照透析管理相关章节进行毒素清除。
3. 残余肾功能的下降:在 CKD早期即已发生左心室结构、功能异常及心肌纤维化,促使 CKD相关心肌病的发生[111]。随着 eGFR下降,LVH的发生率逐渐升高,在 eGFR<30 ml/min患者中仅 16%~31%,而在透析患者中则超过 90%[112]。在透析患者尤其是 PD患者中,残余肾功能对于维持良好的液体平衡是重要的,残余肾功能下降将导致容量超负荷及心力衰竭的发生[113]。研究认为,应避免过度利尿、腹膜炎、低血压等对残余肾功能的影响[114];ACEI/ARB治疗可延缓 PD患者残余肾功能的下降,并可减少心力衰竭事件的发生[115]。推荐按照 PD管理相关章节保护残余肾功能。
推荐意见
21. 推荐PD患者应用ACEI/ARB延缓残余肾功能的下降。(推荐程度Ⅰ,证据质量A)
4. 微炎症与氧化应激:炎症被认为是肾功能不全导致心力衰竭的主要机制 [94]。一些研究证实炎性因子如 C-反应蛋白及促炎因子如肿瘤坏死因子、白细胞介素 6等与透析患者及心力衰竭患者的死亡密切相关[116]。首先,尿毒症可促进活性氧自由基(reactive oxygen species,ROS)生成、加重氧化应激,进一步可刺激炎性反应[117]、诱导内皮细胞功能不良、血管舒缩障碍、血管内膜增厚,参与动脉粥样硬化的发生和发展[118];其次,容量负荷过重导致的心力衰竭常伴随 ROS水平增加[99]。动物实验发现,线粒体呼吸受损导致 ROS增加是容量负荷过重导致心室功能不良的重要机制[119];此外, β肾上腺能受体激活加剧心肌重塑及心力衰竭的发展进程,而最新研究发现,炎症与氧化应激途径为其中重要的非经典途径[120];同时,营养不良-炎性反应综合征可促进透析患者发生粥样硬化性血管疾病[116],后者是心力衰竭强有力的预测因子。建议通过充分透析、避免感染等途径减轻透析患者的炎症及氧化应激水平。
5. CKD-矿物质与骨异常(CKD-mineral and bone disorder,CKD-MBD):传统观点认为, CKD-MBD常常是通过异位钙化,尤其是冠状动脉等血管钙化、心脏瓣膜钙化,直接或间接介导脉压和脉搏波传导速度增加、冠状动脉舒张期灌注减少、心脏后负荷增加,导致心肌缺血、 LVH的发生及 CVD风险的增加。近期研究证实, CKD-MBD亦可通过以下非钙化机制导致 LVH的发生和发展。
(1)成纤维细胞生长因子-23(fibroblast growth factor-23, FGF-23)升高:合并 CKD-MBD透析患者 LVH的发生伴随着 FGF-23水平升高 [121-123],FGF-23可通过非 Klotho依赖的途径直接激活心肌细胞成纤维细胞生长因子受体 4(FGFR4)、上调磷脂酶 Cγ/钙调磷酸酶-活化的 T细胞核因子(calcineurin-nuclear factor of activated T cells,钙调磷酸酶-NFAT)信号通路导致 LVH[121]。此外,FGF-23亦可通过上调肾脏 Na+-Cl-同向转运子、促进钠离子吸收等导致容量负荷增加、高血压和 LVH[124],已有研究证实,FGF-23与心力衰竭患者住院率及死亡率相关 [125]。
(2)维生素 D缺乏:维生素 D可通过抑制肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)、抗炎、抗氧化[126]、抑制钙调磷酸酶-NFAT信号通路进而抑制 LVH[127]等多种效应发挥心血管保护作用,故透析患者维生素 D缺乏或将促进 LVH发生,但仍需进一步研究证实。
(3)甲状旁腺素(parathyroid hormone,PTH)升高:PTH可过度激活心肌成纤维细胞,进而诱导心肌间质纤维化[126];临床研究也证实了 PTH与 LVH之间的关系,应用拟钙剂降低 PTH可改善心功能及 LVH[128]。
综上,CKD-MBD可通过钙化及非钙化机制导致 LVH,增加心力衰竭风险。推荐根据 KDIGO 2017年 CKD-MBD临床实践指南[129]及2019版《中国 CKD矿物质和骨异常诊治指南》[130]对相关指标进行监测及管理,临床强调血钙、磷、PTH综合联动管理,以使透析患者获益最大。
推荐意见
22. 推荐按照KDIGO 2017年CKD-MBD临床实践指南及 2019版《中国 CKD矿物质与骨异常诊治指南》监测及管理透析患者的 CKD-MBD相关指标。(推荐程度Ⅰ,证据质量A)
6. 贫血:贫血可导致心脏前负荷增加,与透析患者的心力衰竭显著相关 [66];即使在校正了年龄、糖尿病和缺血性心脏病后,贫血仍是透析患者心力衰竭的独立危险因素[131]。应用红细胞生成刺激剂(erythropoiesis-stimulating agents,ESA)或静脉铁剂纠正贫血后, LVH、心功能及生活质量得到相应提升[132];而红细胞生成素本身也能够通过减少心肌细胞及内皮细胞凋亡、增加内皮祖细胞数量、改善内皮细胞功能、促进心肌血管生成等非贫血依赖机制,改善心功能 [133]。
对于贫血的管理,以血红蛋白≥110 g/L为目标值,但不推荐>130 g/L,主要治疗药物包括口服或静脉铁剂、红细胞生成素及低氧诱导因子脯氨酰羟化酶抑制剂(hypoxic inducible factor prolyl hydroxylase inhibitor,HIF-PHI)[134-137]。
推荐意见
23. 推荐应用铁剂、ESA或 HIF-PHI纠正透析患者的贫血。(推荐程度Ⅰ,证据质量A)
(三)透析相关因素
1. HD血管通路:建立动静脉内瘘( arteriovenous fistulas,AVF)后,局部血流动力学发生变化,部分血流不经过毛细血管床而直接通过 AVF通路进入静脉,导致有效心输出量不足及 “内瘘相关窃血 ”诱发心力衰竭 [138]。Reddy等[139]通过回顾性分析也发现 AVF手术与显著的右心室扩张和右心室功能恶化有关。还有研究发现 AVF及人工血管移植物内瘘( arteriovenous graft,AVG)可引起心脏前负荷增加,发生左心室肥厚、扩张,进而出现左心室收缩和 /或舒张功能减退 [140]。此外,高流量 AVF也是导致 ESRD患者高输出量型心力衰竭的危险因素之一 [141],当心肌收缩功能受损与高流量 AVF同时存在时会出现心力衰竭临床表现,如胸闷、呼吸困难等左心衰竭症状 [142],或恶心、呕吐等右心衰竭症状 [143]。对 AVF/AVG的管理详见 HD管理章节。
2. HD治疗:Foley等[144]研究证实,启动 HD治疗 18个月后, 62%的患者左心室质量指数增加,其中 49%的患者发生明显的左心衰竭,提示 HD本身可能促进 LVH的发生。相比于 PD而言, HD患者尤其在透析后第1年,新发心力衰竭的风险更高 [145]。这可能与以下因素有关:首先, HD可反复诱发心肌缺血和心肌顿抑,最终进展为心脏收缩功能障碍、血流动力学异常,表现为 TnT升高、透析中低血压、致死性心律失常或心源性猝死 [146-148]。其次, HD患者,尤其是治疗过程中反复发生血流动力学波动的患者,更易发生再灌注损伤 [149]。此外, HD患者尿毒症毒素的蓄积、微炎症状态的持续存在以及 HD对氧化应激的加剧作用,都是导致心力衰竭发生风险增高的重要原因。HD管理详见 HD管理章节。
3. PD相关并发症:研究显示,频发或严重的PD相关性腹膜炎可损害腹膜基本结构,导致腹膜纤维化及超滤衰竭 [150],进一步将可能影响PD患者容量平衡及透析充分性,而慢性容量超负荷、炎症等多种机制会增加心力衰竭风险。此外,PD相关机械性并发症如腹透液渗漏、PD管堵塞、PD管移位等亦可影响 PD超滤量,导致容量负荷增加、心力衰竭风险增加。建议积极预防 PD相关感染性及机械性并发症。
二、 HD管理
(一)维持性血液透析(maintenance hemodialysis,MHD)患者心力衰竭的预防
1. 优化容量状态:优化容量状态是 MHD患者心力衰竭管理的重要目标。容量状态的优化措施包括:准确评估容量状态、调定最佳干体重、控制透析间期体重增长等。
推荐意见
24. 优化容量状态是MHD患者心力衰竭管理的重要目标。(推荐程度Ⅰ,证据质量C)
(1)容量状态评估:
①临床评估:临床评估包括病史回顾及体格检查两部分。病史回顾应仔细询问患者透析中与直立性低血压相关的症状(如头晕)和肌肉痉挛等传统低血容量症状,以及透析间期血压控制以及高血容量相关的症状(如水肿、呼吸困难)。体格检查应重点关注外周水肿、颈静脉充盈、第三心音及肺部湿啰音等特征性表现。
推荐意见
25. 对于MHD患者,容量状态评估应首先基于临床评估(病史回顾及体格检查)。(推荐程度Ⅰ,证据质量C)
②无创检查方法:无创检查法主要包括超声检查、生物电阻抗分析及相对血容量( relative blood volume,RBV)监测,目前尚无充足证据证实何种方法最佳,故我们建议因地制宜选择检查方法,在有条件的情况下综合应用上述方法评估患者容量状态。
A. 超声:利用超声心动图测量下腔静脉直径和塌陷度,对 HD患者血容量超负荷较为敏感,是临床较为常用的无创性检查方法[151]。肺部超声是近年来新兴的另一项超声技术,可被用于评估肺间质血管外水肿。研究显示,通过肺部超声中 B线(又称为“彗星尾线”)的简单计数,即可评估肺部多余的水分,快速判断透析患者临床或亚临床淤血 [152-153],具有可行性强、重复性强、简单快捷等特点。但这一方法仅能用于容量超负荷的患者,对容量负荷正常或过低的患者作用有限。
B. 生物电阻抗分析:生物电阻抗分析是利用身体的电阻、电抗和电流评估机体总液量、细胞外液及细胞内液的方法。Machek等[154]研究显示,应用生物电阻抗分析可以优化血压控制、避免透析患者低血压事件;另有一项系统性综述认为,生物电阻抗是目前临床上指导透析患者液体管理最精确及可靠的工具[155]。然而,一项联合生物阻抗和肺部超声指导 HD患者容量管理的前瞻性、随机、开放标签研究并未发现上述方法对患者全因死亡及首次心血管事件具有改善作用 [156]。
C. RBV:RBV监测是基于质量守恒原则的无创监测技术,即透析患者血液成分中血细胞总数、白蛋白等物质保持恒定,通过检测某一成分浓度的变化即可了解容量的变化情况。RBV计算公式如下:RBV(%)=([1-C0/Ct])× 100%,C0和 Ct分别表示 HD开始时和 HD期间血液成分浓度。大多数仪器以血红蛋白、血细胞比容或血浆蛋白作为标志物。一般认为,RBV大于 85%为血容量变化的安全阈值。RBV已被证明有助于设定易发生透析中休克性低血压个体的临界血容量[157],故可应用于伴有透析中严重低血压的心力衰竭患者。
推荐意见
26. 对 MHD患者,可考虑采用超声、生物电阻抗及 RBV等无创检查方法辅助进行容量状态评估。(推荐程度Ⅱb,证据质量C)
(2)干体重的调定:干体重的设定应基于容量评估结果。一旦容量评估完成即开始干体重调定。干体重调定应逐步进行,建议通过数天到数周的时间来达到目标干体重[158-159]。对于能良好耐受的患者,我们建议每次透析将体重调低 0.5 kg;对于不能耐受的患者,建议每次调低 0.2~0.3 kg。
推荐意见
27. 对于完成容量评估的 MHD患者,建议通过数天或数周逐步达到目标干体重。(推荐程度Ⅰ,证据质量B)
(3)控制透析间期体重增长:根据《中国血液透析充分性临床实践指南》[71],我国患者透析间期体重增长应控制在干体重的 5%以下。控制透析间期体重增长的主要策略是限制水盐摄入,建议此类患者每日食盐摄入量<5 g[160];对于血清 Na+<135 mmol/L的患者,严格限制水分摄入[71]。
推荐意见
28. 对于MHD患者,透析间期体重增长应控制在干体重的 5%以下。(推荐程度Ⅰ,证据质量B)
2. 实现充分透析:充分透析是 MHD患者治疗的根本。根据《中国血液透析充分性临床实践指南》[71],MHD患者应达到每周 3次、每次 4.0~4.5 h的治疗;在此基础上,以单室尿素清除率(spKt/V)≥1.2、尿素下降率(UUR)≥65%、β2-微球蛋白( β2-microglobulin,β2-MG)下降率 ≥30%为溶质清除充分性标准;每 3个月进行一次充分性评估,对不能达标的患者,及时调整透析方案并处理可能的血管通路异常。
运用高通量透析有助于尿毒症毒素清除。HEMO研究[161]显示,相较低通量透析,高通量透析可减轻患者 CVD相关死亡风险及 CVD相关死亡或住院的复合风险;进一步亚组分析提示,接受高通量透析>3.7年的患者在总体生存率和 CVD相关生存率方面都有显著获益。一项纳入10项研究、2915例患者的 Meta分析发现,高通量透析可显著降低 CVD相关死亡率 [162]。因此,推荐 MHD患者选择高通量透析。
血液透析滤过(hemodiafiltration,HDF)将高通量透析和大量超滤相结合,可以提高对流传输的量级,从而显著增加中分子尿毒症毒素的清除,有助于更好地控制贫血、更有效地清除血磷、改善脂质、减少炎症和氧化应激[163],故而对于预防透析患者心力衰竭发生具有积极意义。研究显示,与常规透析相比, HDF可以显著改善左心室质量、防止主动脉僵硬和左心室舒张能力的显著恶化[164];来自土耳其在线 HDF研究的结果显示,当置换液剂量>17.4 L/次时, HDF可较高通量透析进一步降低患者死亡率和 CVD相关死亡率[165]。然而,治疗费用昂贵限制了这一治疗方式的广泛应用,其成本-效益比仍需进一步研究。因此,对于有条件的 MHD患者,我们建议进行在线 HDF治疗,置换液剂量>17.4 L/次。
膜的生物相容性可能会影响患者的 β2-MG蓄积、营养状况、易感染性、全身微炎症状态和残余肾功能,而这些均可能对心力衰竭发生及患者预后产生影响[166]。合成的非纤维素膜比纤维素膜具有更好的生物相容性,临床常见的可用合成膜包括聚丙烯腈、聚砜、聚碳酸酯、聚酰胺和聚甲基丙烯酸甲酯膜。对于 MHD患者,我们推荐采用生物相容性更好的膜材料进行透析治疗。
推荐意见
29. 为预防心力衰竭, MHD患者应实现充分透析,其主要策略为:严格进行透析充分性管理、采用高通量透析、进行在线 HDF及选用生物相容性好的膜材料。(推荐程度Ⅰ,证据质量A)
3. 预防血管通路相关心力衰竭:推荐对所有拟建立血管通路的患者进行术前心力衰竭评估,并对心力衰竭风险高(AVF明显扩张、可疑的高流量或高位AVF/AVG)的 AVF/AVG患者进行定期随访[139,167]。其中,高流量 AVF/AVG的定义为内瘘血流量(Q)>1.5 L/min,或内瘘血流量与心输出量比值>20%[167-168]。对于术前评估EF<30%的透析患者,不建议建立 AVF/AVG[169]。
为预防血管通路相关心力衰竭,对于心力衰竭风险高的患者或已存在心力衰竭的患者,应避免高位 AVF/AVG,尽量选择建立前臂 AVF/AVG;在吻合时采用端-侧吻合可能有利于避免侧-侧吻合带来的高血流量。
推荐意见
30. 推荐对所有拟建立血管通路的患者进行术前心力衰竭评估,并对心力衰竭风险高(AVF明显扩张、可疑的高流量或高位 AVF/AVG)的 AVF/AVG患者进行定期随访(推荐程度Ⅰ,证据质量B);对于术前评估 EF<30%的患者,不建议建立 AVF/AVG(推荐程度Ⅲ,证据质量C)。
31. 对于心力衰竭风险高的患者或已存在心力衰竭的患者,建议避免可能带来高血流量的内瘘吻合方式。(推荐程度Ⅱa,证据质量C)
(二) MHD患者心力衰竭的治疗
1. 强化透析:近年来,有研究证实强化透析有助于改善透析患者 LVH及心力衰竭症状,是 MHD患者心力衰竭的一种治疗选择[170]。强化透析的定义是更频繁和 /或更长时间的透析,一般来说,强化透析是指每次透析的持续时间超过 5.5 h及/或每周透析 3~7次[171],其优势在于改善血压控制、减少左心室质量、减少透析中低血压以及提高血磷及中分子尿毒症毒素(如 β2-MG)的清除[172-174]。一项 RCT显示,与常规 HD(每周 3次)相比,高频 HD(每周 6次)降低了死亡率及左心室质量[175]。相比较而言,长时夜间 HD未能在改善死亡率及左心室质量方面得到一致性的结果 [176]。
推荐意见
32.对于 MHD心力衰竭患者,推荐采取增加透析频率的强化透析方案。(推荐程度Ⅰ,证据质量B)
2. 连续性肾脏替代治疗(continuous renal replacement therapy,CRRT):CRRT在缓慢精确清除液体、持续清除溶质及炎症介质、更好地维持酸碱平衡及血流动力学稳定性等方面较间歇式血液透析(intermittent hemodialysis, IHD)治疗具有明显优势。因而,对于 MHD心力衰竭患者,尤其是因反复发生透析中低血压等原因不能耐受 IHD的患者, CRRT更有利于维持其血流动力学稳定性、精确液体管理、避免心肌缺血;对于严重失代偿的心力衰竭患者,尽早行 CRRT可能有助于预防进一步的器官损伤,防止多器官功能障碍的进展[177]。一项 RCT研究[178]显示,与缓慢连续超滤(slow continuous ultrafiltration,SCUF)相比, CRRT可更显著地改善合并心力衰竭患者的生存时长,且这种优势主要存在于尿量< 10 ml/h的患者中,这可能主要与 CRRT对 IL-6、TNF-α等炎性因子的清除及其对残肾功能的影响有关。由于透析患者长期处于微炎症状态, CRRT治疗也可能使此类患者得到类似获益。
推荐意见
33. 对于MHD心力衰竭患者,尤其当其不能耐受IHD时,推荐采用CRRT治疗。(推荐程度Ⅰ,证据质量B)
3. 治疗血管通路相关心力衰竭:对于已建立AVF/AVG的患者,如出现心力衰竭表现或原有心力衰竭表现加重,应及时进行 AVF/AVG血流监测及超声心动图检查。
对于并发血管通路相关心力衰竭的患者,当心指数 ≥3.9 L·min-1·m-2时,可选择内瘘减流手术[179]。常见的减少内瘘流量的方法包括环阻法缩窄内瘘流出道和建立旁路减流[142]。然而,对环阻法而言,内瘘缩窄程度较难把握,缩窄过多或过少将分别导致血栓风险增加及减流无效,目前尚无量化标准,应根据患者实际情况谨慎实施[143,180-182]。
对于血管通路相关心力衰竭患者,如为难治性心力衰竭,建议关闭 AVF/AVG,选择建立带涤纶套的中心静脉导管、对侧肢体重新建立远端肢体内瘘或改行 PD治疗。一项纳入64例患者的 RCT研究显示,关闭内瘘使得左右心室容积、心输出量、左心房容积和 NT-proBNP水平降低,基线内瘘流量较高的患者左心室质量减小程度更为明显 [183]。
推荐意见
34. 对于已建立AVF/AVG的患者,如出现心力衰竭表现或原有心力衰竭表现加重,应及时进行 AVF/AVG血流监测及超声心动图检查。(推荐程度Ⅰ,证据质量C)
35. 对于血管通路相关心力衰竭患者,当心指数 ≥3.9 L·min -1 ·m -2时,建议选择内瘘减流手术。(推荐程度Ⅱa,证据质量C)
36. 对于血管通路相关心力衰竭患者,如为难治性心力衰竭,建议关闭 AVF/AVG。(推荐程度Ⅱa,证据质量B)
4. 其他:对于部分反复出现透析中低血压的心力衰竭患者,可应用低温透析液(<35 ℃)增加全身血管阻力、提高心脏收缩力、减少左心室质量,减轻相关症状[184-185];也可通过个体化设定透析液钠浓度,从而减轻相关症状,具体方法为:测定 3次透析前钠浓度,计算透析前平均血钠浓度,以其乘以 95%即为个体化透析液钠浓度[186]。
推荐意见
37. 对于反复出现透析中低血压的 MHD心力衰竭患者,可考虑应用低温透析液(<35 ℃)或个性化设定透析液钠浓度。(推荐程度Ⅱb,证据质量B)
三、 PD管理
PD是一种基于家庭的治疗方式,可以持续清除钠和水以保持良好的容量状态,并且避免了与血管通路相关的心力衰竭风险,因此被认为是透析心力衰竭患者,尤其是顽固性心力衰竭患者的适宜治疗方式。已有系统评价显示,PD可以改善心脏功能状态(包括 LVEF和心功能分级)、减少心力衰竭患者再入院率[187]。值得注意的是,PD对容量的控制及心力衰竭的防治必须在专业 PD随访团队的指导下,持续优化治疗方案,才能获得最大的获益[188]。
推荐意见
38. PD有利于改善透析心力衰竭患者心脏功能状态、减少心力衰竭再入院率,是此类患者适宜的治疗方式。(推荐程度Ⅰ,证据质量B)
(一) PD患者心力衰竭的预防
1. 优化非药物治疗:
(1)限制水盐摄入:与 HD患者类似,严格限制水盐摄入是 PD患者管理的重要方法。限制水分摄入的总原则是量出为入,保持平衡。理想的摄入量为前一日尿量 +超滤量+500 ml[160]。限盐比限水更重要,尤其是使用自动化腹膜透析(automated peritoneal dialysis,APD)机的患者由于钠筛作用易导致钠潴留,进而影响血压控制及心力衰竭防控[189]。因此,建议在营养师指导下对 PD患者进行科学合理的限盐[190]。一般情况下,无高血压者食盐摄入量< 6 g/d,合并高血压者< 3 g/d[191]。
应关注患者因水盐限制导致日常行为模式转变,而对情绪及心理的影响,避免导致生活质量下降。医务人员除了告知水盐限制的必要性、方法和技巧以外,仍需给予制定可行的循序渐进的方案,通过鼓励、理解、肯定效果并提出不足及解决方案,提高患者对疾病的认知程度、增强自信及实现主观能动性[192]。
推荐意见
39. 为预防心力衰竭, PD患者应严格限制水钠摄入。(推荐程度Ⅰ,证据质量C)
(2)加强体重监测:在 PD治疗中,应加强对患者体重的监测,建议患者每日称体重时尽量只穿贴身的衣服,更换一袋透析液后立即称量,减去透析液重量后记录体重。此外, PD中心应定期结合患者临床表现及无创检查结果(方法参考 HD患者管理部分)进行个体化容量评估,帮助患者设定最佳干体重。
推荐意见
40. 为预防心力衰竭,PD患者应加强体重监测,推荐每日测量并记录体重。(推荐程度Ⅰ,证据质量C)
2. 优化 PD处方:
(1)采用优化的 PD模式:对于转运功能较高、夜间超滤量较少的患者,应根据残肾功能不同情况,优化 PD治疗模式,避免容量扩增,预防心力衰竭发生。若残肾功能较好,可采用日间不卧床腹膜透析(day ambulatory peritoneal dialysis,DAPD),或夜间间歇性腹膜透析(nocturnal intermittent peritoneal dialysis,NIPD)模式,但需注意,此种模式易因钠筛作用致钠潴留,故应定期监测血钠,限制水盐摄入,或联合利尿剂,保证尿钠清除。PD模式调整的示例方法已列入表 6。

推荐意见
41. 为预防心力衰竭,PD患者建议采用优化的PD模式。(推荐程度Ⅱa,证据质量C)
(2)PD联合 HD治疗:联合 PD和 HD(PD+HD)治疗是长程维持性 PD患者超滤不足或容量不易控制时的有效措施[198]。由于联合治疗时容量更易控制,心肌缺血发生率也低于直接转为 HD的患者,因此这种方式比较适用于合并冠心病或有 CVD高危风险的患者。推荐方案为每周 5~6 d PD,每周 1次 HD,HD当天不做 PD。研究显示,这一方案不仅可解决此类患者容量负荷的问题,还可改善贫血、减轻左心室肥厚、延缓残肾功能下降[199-200]。此外,由于该方案可减少高渗透析液的使用,降低了腹膜损伤的风险,也使得腹膜超滤功能衰竭的患者仍有继续长期 PD的可能。
推荐意见
42. 为预防心力衰竭,PD患者如存在超滤不足或容量不易控制,可选择 PD联合 HD治疗。(推荐程度Ⅱa,证据质量B)
(3)保证腹透通路通畅:对于容量超负荷的患者,应排除机械性因素导致的引流不畅。引流不畅表现为突然超滤量减少伴引流速度减慢,对于此种情况应及时行腹部立位片明确腹透管位置,及时纠正机械性因素。此外,如腹透液中可见纤维蛋白,应查腹透液常规排除腹腔感染可能;如确实存在感染,应积极治疗(见图 2)。
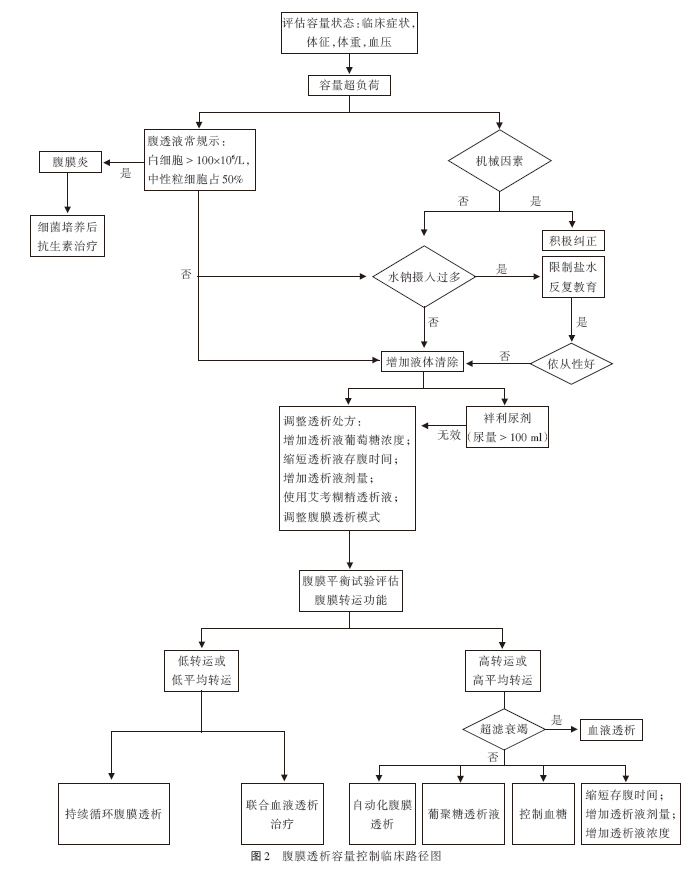
(二) PD患者心力衰竭的治疗
不同于 HD,PD可持续、缓慢清除机体多余的液体和钠,对血流动力学的影响更小、患者耐受程度更高。此外,在右心衰竭的情况下,腹透管作为引流腹水的通路,有利于腹内压的下降,在改善心力衰竭的同时保护残肾功能[194]。因此,通过PD处方的精细化调整与优化,可有效地防治心力衰竭。
对于明确为容量超负荷导致的心力衰竭,可以通过增加 PD超滤量来减轻容量负荷。欧洲 PD临床指南将每日总液体出量(超滤量与尿量的总和)至少保持在 750~1000 ml作为额外的充分性评估指标[201]。因此,科学强化超滤对于改善透析患者心力衰竭具有重要意义。鉴于超滤量取决于许多参数,包括用于每次交换的葡萄糖溶液的浓度、留腹的时间和单个患者的腹膜转运特性等,故强化超滤具体措施包括以下几个方面:
1. 增加透析液葡萄糖浓度:国内目前主要使用的葡萄糖透析液共有 1.5%、2.5%及 4.25%三种浓度,随葡萄糖浓度增加,渗透压升高,超滤能力增强。每将一袋 1.5%葡萄糖透析液改为 2.5%葡萄糖透析液,平均可增加超滤量 200 ml。但对于转运功能较高,或透析处方已全部使用2.5%透析液者,可每日增加 1袋 2.5%透析液,和/或将2.5%透析液改为4.25%透析液,以增加超滤量。但由于4.25%葡萄糖透析液更易导致腹膜损伤,因此,应尽可能避免长期使用。
2. 缩短透析液存腹时间:超滤脱水是因为透析液与腹膜毛细血管内血浆存在渗透压梯度。随着时间的推移,渗透压梯度逐渐下降,最后达到平衡,在这个过程中,超滤逐渐下降,甚至在多种因素作用下形成负超滤。更换下一袋透析液,再次形成渗透压梯度,产生超滤。大多数患者每次灌入量 2000 ml、存腹 2.5~3.0 h时即达最大超滤,尤其对于转运功能较高的患者,存腹很短时间血与腹透液渗透压便达到平衡,因此,应尽量避免长时间存腹而引起负超滤。
3. 增加透析剂量:对于残余肾功能较差、透析不充分的患者,增加透析液总剂量、缩短每袋存腹时间,可以实现更多的水和溶质清除,并可减少高渗透析液的使用,避免腹膜损伤。
推荐意见
43. 对于 PD心力衰竭患者,增加透析液葡萄糖浓度、缩短透析液存腹时间、增加透析剂量,有利于改善容量,纠正心力衰竭。(推荐程度Ⅰ,证据质量C)
4. 使用艾考糊精透析液:艾考糊精是一种高分子量的葡萄糖聚合物,通过胶体渗透产生超滤。它不跨越毛细血管壁,增加胶体渗透而不激活腹膜水通道蛋白,使所有超滤发生在细胞间孔隙,从而消除水通道蛋白的钠筛作用,在清除水分的同时能够清除更多的钠。因此,艾考糊精透析液适用于需要强化超滤的患者。一些 RCT研究表明,艾考糊精在改善超滤方面优于高渗葡萄糖溶液,特别是在腹膜高转运的患者中更为显著,但同时也适用于腹膜低转运的患者[202-203]。多项临床试验表明,夜间使用艾考糊精交换可以成功管理容量超负荷的难治性心力衰竭患者[204-205]。需要注意的是,艾考糊精透析液的成本较高,长期使用仍需要进行成本效益分析研究。对于心力衰竭患者,建议在充分评估容量、心功能、腹膜转运功能等因素的基础上,综合考量后决定是否需要长期全部使用艾考糊精透析液或是与葡萄糖透析液搭配的透析处方,以达到最优化的成本效益治疗。
推荐意见
44. 对于PD心力衰竭患者,推荐使用艾考糊精透析液增加超滤。(推荐程度Ⅰ,证据质量A)
5. 调整PD治疗模式:对于 PD心力衰竭患者,尤其是对利尿剂抵抗、转运功能较高、夜间超滤少的患者,若残肾功能好,可短期采用间竭性 PD的模式,有利于快速增加水分清除,改善容量。但这种模式由于交换频繁,需要患者卧床,活动受限,透析液在腹腔存留时间较短,长期使用有可能导致钠潴留(钠筛作用)。NIPD治疗可能因超滤过快、血流动力学不稳定,从而影响肾灌注,导致残肾功能下降。而对于残肾功能较差的患者,可采用持续循环腹膜透析(continuous cycling peritoneal dialysis,CCPD),保证溶质和容量清除,避免钠筛作用,但费用会增加。
推荐意见
45. 对于PD心力衰竭患者,可通过调整PD模式改善超滤。(推荐程度Ⅱa,证据质量B)
四、药物管理
药物治疗的主要目的是改善患者症状、提高生活质量、减少再住院以及降低死亡率。值得一提的是,尽管大部分心力衰竭治疗药物在非透析人群中已积累了大量的高质量证据,但 ESRD尤其是透析因素的存在使透析患者的药物治疗更加复杂。事实上,基于对药物潜在不良反应的担忧,大多数 RCT排除了透析患者,导致这些药物在透析患者中的证据不足[206]。在这里,专家组就现有的有限临床证据形成了药物治疗的初步意见,但这些意见仍需在临床实践中进一步检验完善。
(一) HFrEF的药物治疗
1. 利尿剂:利尿剂治疗有助于增加水钠排泄,减少透析时容量清除的需求,改善运动耐量。由于袢利尿剂更有利于改善水钠潴留且不易影响残余肾功能[207-208],因此在大多数情况下建议作为首选。对于 PD患者,呋塞米的每日剂量可达250~500 mg[209]。目前袢利尿剂在 HD患者中的安全使用剂量还缺乏证据,但根据经验,每日不超过120 mg的呋塞米是安全的。考虑到药物潜在的不良反应,建议使用期间监测听力和皮肤改变。此外,一旦尿量减少到可忽略不计,应停止利尿剂的使用。
推荐意见
46. 对于仍保有尿量且存在液体潴留的透析伴 HFrEF患者,建议使用利尿剂治疗,首选袢利尿剂。(推荐程度Ⅱa,证据质量B)
2. β受体阻滞剂:在透析患者中,去甲肾上腺素高水平与较高的不良心血管事件和死亡率相关,这为透析患者使用 β受体阻滞剂提供了一定的依据[210]。在一项纳入了 114例伴有 HFrEF的透析患者的 RCT研究中,受试者在标准治疗的基础上随机接受卡维地洛或安慰剂治疗,结果显示,卡维地洛可明显改善 LVEF和 NYHA分级、延缓病理性心肌重构,显著降低全因死亡率、 CVD相关死亡以及全因住院风险[211]。另一项回顾性研究比较了 1700例接受 β受体阻滞剂(卡维地洛、比索洛尔和美托洛尔控释/缓释制剂)治疗的 HD心力衰竭患者与 1700例倾向性匹配患者的 5年死亡率,与对照组相比, β受体阻滞剂组死亡率显著降低[212]。另一方面,有学者认为,HD对不同 β受体阻滞剂的清除能力不同可能导致预后差异。一项纳入 6588例 HD患者的回顾性研究显示,与容易被透析清除的 β受体阻滞剂(如美托洛尔)相比,不易被清除的药物(如比索洛尔或卡维地洛)具有更显著的生存优势[213]。近期一项前瞻性队列研究进一步对比了卡维地洛和比索洛尔对 HD患者(比索洛尔组 9305例、卡维地洛组 11171例)死亡和主要心脏不良事件的影响,结果显示,与卡维地洛相比,比索洛尔尽管透析清除率更高,却使全因死亡率降低了 34%、心力衰竭风险降低 17%[214]。上述研究提示,在β受体阻滞剂的选择方面,应兼顾药物的透析清除率与药物的心脏选择性。此外,应强调的是,在使用时, β受体阻滞剂需以较低的剂量起始以降低血流动力学恶化的风险,尤其是在既往有透析期间低血压或持续性低血压的患者中。
推荐意见
47. 对于透析伴 HFrEF患者,推荐给予 β受体阻滞剂治疗。(推荐程度Ⅰ,证据质量B)
3. 血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI):已有多项 RCT证实 ACEI可为不伴有或伴有轻度 CKD的 HFrEF患者带来获益[215],主要是由于 ACEI可以改善心室重构和对左心室射血分数的影响[216]。鉴于目前尚缺乏 ACEI在透析伴心力衰竭患者中使用获益的直接证据,因此这一推荐主要基于在不伴有或伴有轻度 CKD的 HFrEF患者中获益的间接证据。在 FOSIDIAL试验中,福辛普利被用于左心室肥厚 HD患者的治疗,结果心血管事件较安慰剂组呈现下降趋势,但组间差异无统计学意义[217]。在多个回顾性研究中, ACEI也显示出了降低透析患者死亡率等方面的优势[218-219]。尽管现有证据大部分来源于观察性研究或注册数据分析,对在此类患者中应用 ACEI的安全性和有效性的支持作用有限,但 ACEI对神经激素激活、血流动力学、心室重构和左心室肥厚的改善作用可使伴有左心室功能障碍和心力衰竭的透析患者的心血管事件减少[220-221]。在 PD患者中, ACEI还被证实可有效延缓残肾功能下降[222],并对腹膜功能有潜在保护作用[223]。值得注意的是, ACEI在给药时应考虑其半衰期和透析的清除作用。此外,鉴于 ACEI可能导致透析患者高钾血症发生风险显著升高,因此需要密切监测血清钾浓度[224],必要时配合使用降钾药物。
4. 血管紧张素 Ⅱ受体阻滞剂(angiotensinⅡreceptor blocker,ARB):ARB也是透析伴 HFrEF患者治疗的合理选择。意大利进行的一项 RCT研究显示,相比安慰剂,替米沙坦治疗显著降低了伴心力衰竭透析患者的全因死亡、心力衰竭住院和 CVD相关死亡风险[225] 。另一项荟萃分析评估了 ARB或 ACEI用于 HD患者的疗效,亚组分析显示,与其他降压药或安慰剂相比, ARB治疗与更低的心血管事件和心力衰竭事件相关[115] 。此外, ARB也被证实可延缓 PD患者的残肾功能下降速度[226] ,并对腹膜功能有潜在保护作用[223,226] 。
对于 ARB联合 ACEI用于伴有 HFrEF的透析患者尚有争议。对于使用最佳剂量 β受体阻滞剂联合 ACEI治疗后仍持续存在心力衰竭症状的透析患者,应评估添加 ARB的潜在风险和获益。由于可能存在高钾血症和透析中低血压, ACEI和 ARB联合应慎用于 HD患者。国外一项研究支持在透析患者中联用 ACEI和 ARB,在这项多中心试验中,对332例伴有 HFrEF的 HD患者随机分组,在 ACEI标准治疗基础上加用 ARB或安慰剂,随访 3年的结果显示,ACEI联合 ARB治疗较单用 ACEI显著降低了41%全因死亡风险、58% CVD相关死亡风险和 62%心力衰竭住院治疗风险[225]。
推荐意见
48. 对于透析伴HFrEF患者,建议在 β受体阻滞剂的基础上联用 ACEI/ARB治疗。(推荐程度Ⅱa,证据质量B)
5. 血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI):对于伴 HFrEF的透析患者,我们建议使用 ARNI控制心力衰竭症状、改善心肌重构。ARNI可同时作用于 RAAS系统和脑啡肽酶,一方面阻断 AT1受体与血管紧张素 Ⅱ结合,抑制 RAAS的不利作用;另一方面抑制脑啡肽酶,抑制利尿钠肽降解,使内源性利尿钠肽水平升高,增强利尿钠肽系统的保护作用,逆转或减少左心室重构[227]。ARNI的代表药物是沙库巴曲缬沙坦钠。在大型随机对照临床试验 PARADIGM-HF中,压倒性的证据表明,与依那普利相比,沙库巴曲缬沙坦钠使主要复合终点(CVD相关死亡和心力衰竭住院)风险降低 20%,全因死亡减少 16%,且 eGFR和尿白蛋白 /肌酐比值均不影响沙库巴曲缬沙坦钠对心力衰竭住院及 CVD相关死亡的改善作用[228],显示了沙库巴曲缬沙坦钠对 CKD患者的安全性和有效性。一项纳入了932例患者、来自中国台湾的真实世界研究证明,沙库巴曲缬沙坦可以使伴有 HFrEF的 CKD 4~5期患者的主要心血管事件风险降低 28%[229]。另一项纳入了 23例透析合并心力衰竭患者的回顾性研究证实,沙库巴曲缬沙坦可以改善患者的 LVEF和心肌标志物水平[230]。在 2019年 KDIGO会议共识中,沙库巴曲缬沙坦已被列为治疗 HFrEF合并 CKD的基石药物,并被认为可用于合并 HFrEF的透析患者[231]。沙库巴曲缬沙坦的一大优势在于其与血浆蛋白结合率高,不易被 HD清除[232]。另一方面,越来越多的 RCT及 Meta分析显示,沙库巴曲缬沙坦钠可显著延缓肾功能恶化[233],因此可能为保留残余肾功能的透析患者带来额外获益。
推荐意见
49. 对于能够耐受 ARB/ACEI治疗的透析伴 HFrEF患者,建议使用 ARNI替代 ARB/ACEI进一步控制心力衰竭症状、改善心肌重构。(推荐程度Ⅱa,证据质量C)
应避免 ARNI与 ACEI联用,因其均可引起血管性水肿,主要机制可能与二者对缓激肽的分解作用有关[234-235]。一种脑啡肽酶抑制剂与 ACEI的合成制剂曾因严重的血管性水肿及明显增加的死亡率而被叫停[236]。建议在 ACEI停药36 h后再使用 ARN[237]。
推荐意见
50. 应避免ARNI与 ACEI联用(推荐程度Ⅲ,证据质量B);建议在 ACEI停药 36 h后再使用 ARNI(推荐程度Ⅱa,证据质量C)。
51. 对于透析伴HFrEF患者,起始治疗可考虑使用 ARNI,以减少短期不良事件的风险并简化管理流程(避免了从ACEI到ARNI的转化流程)。(推荐程度Ⅱb,证据质量C)
6. 盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonist,MRA):多项研究证实,即使 RAAS系统被阻断,醛固酮突破仍可导致肾脏和心脏疾病的进展,这为在 CKD患者中使用 MRA提供了理论基础[238-240]。在非透析人群中, MRA被证实可以显著降低严重心力衰竭患者的死亡率[241]。在伴有 HFrEF的透析患者中, MRA的使用尚存争议,这主要源于对 MRA引起高钾血症的担忧。早期一项小样本的随机试验表明,尽管存在高血钾风险, MRA治疗仍可降低全因死亡率[242]。2019年两项 RCT研究证实, MRA可使透析患者在心血管方面获益[243-244];另一项针对 10项 RCT研究的荟萃分析显示, HD人群使用 MRA可显著降低 58%的心脑血管事件风险和 54%的全因死亡风险,还可降低左心室质量指数、改善 LVEF,但同时也导致高血钾风险增加了 70%[245]。现有证据表明, HD患者使用小剂量螺内酯(25 mg/d)治疗可能是安全的,但高血钾风险可能随剂量增加而增高[243,246]。另一方面,由于 PD容易合并低钾血症[247],使用 25~75 mg/d螺内酯治疗 2~3个月即可有效升高血钾水平,减少口服钾[248],并可降低收缩压、抑制细菌性腹膜炎引起的腹膜损伤[249],故而对于 PD患者而言,使用螺内酯治疗可能是适宜的。第三代MRA非奈利酮是非甾体类高选择性 MRA,该药物可与盐皮质激素受体结合形成特定的受体-配体复合物以抑制炎性反应及纤维化,在 CKD患者中可能同时发挥保护心脏及肾脏结构 /功能的作用[250]。相比于甾体类 MRA(螺内酯或依普利酮),非奈利酮选择性更高,避免了性激素不良事件的发生[251];在 HFrEF合并 CKD患者中,其引起的血钾升高幅度及高钾血症发生率均低于螺内酯[251]。然而,该药物在透析患者中使用的数据尚缺乏,仍需通过临床研究证实其在透析患者中的安全性及有效性。
推荐意见
52. 对于已经使用最佳剂量的 β受体阻滞剂联合 ACEI/ARB/ARNI治疗但心力衰竭症状仍存在的透析伴 HFrEF患者,经严格筛选并在密切监测下,可考虑使用 MRA治疗。(推荐程度Ⅱb,证据质量B)
7. 地高辛:由于地高辛主要经肾脏排泄,用于透析患者时发生中毒的可能性高于肾功能正常的患者,因此地高辛在透析患者中的应用存在挑战。在一项纳入了 120864例 HD患者的回顾性研究中,地高辛的使用被证实与死亡风险增加有关,这一关系在较低的血清钾水平及较高的地高辛浓度时更为密切:若透析前血清钾水平低于 4.3 mmol/L,地高辛水平 ≥1.0 μg/L,则死亡风险显著增加[252]。因此,对于大部分伴有 HFrEF的透析患者,不建议常规使用地高辛,仅用于接受最佳剂量 β受体阻滞剂治疗后房颤仍未得到控制的患者,且需要根据残余肾功能及肾脏替代治疗模式调整剂量,并密切监测地高辛浓度,确保浓度<1.0 μg/L。
推荐意见
53. 对于大部分透析伴 HFrEF患者,不建议常规使用地高辛治疗。(推荐程度Ⅲ,证据质量B)
8. 其他药物:
(1)伊伐布雷定:伊伐布雷定是一种离子电流抑制剂,在 eGFR<15 ml·min-1·(1.73 m2)-1患者中使用的证据有限。在 CARVIVA-HF试验中,伊伐布雷定7.5 mg bid被用于伴有心力衰竭 HD患者的治疗,结果显示伊伐布雷定与卡维地洛联合比单用卡维地洛的患者表现出更好的运动耐受性和生活质量[253-254]。但该研究样本量小,缺乏以心力衰竭死亡率和住院风险为终点的结果,因此暂不推荐在透析患者中使用伊伐布雷定。
(2)血管扩张剂:对于 ACEI/ARB耐受的伴有 NYHA Ⅱ~Ⅳ级症状的 HFrEF患者,可考虑使用肼屈嗪联合硝酸盐。肼屈嗪和硝酸异山梨酯由于易于滴定,不引起高钾血症,常用于降低透析患者的后负荷和血压。非裔美 国人心力衰竭试验研究证实了肼屈嗪联合硝酸异山梨酯可降低非洲裔美国 HFrEF患者的死亡率,还观察到这二者联用与心力衰竭患者首次住院率下降和生活质量改善相关,而该研究中纳入的肾功能不全患者约占16.2%[255] 。这一研究为血管扩张剂在 CKD患者的使用提供了间接证据,但由于研究者未对肾功能进行详细分期,故这一方案在透析患者中的安全性及有效性仍需进一步研究证实。
(3)可溶性鸟苷酸环化酶(soluble guanylyl cyclase, sGC)刺激剂:sGC刺激剂可通过刺激sGC、增加环磷酸鸟苷(cyclic guanosine monophosphate,cGMP),使心肌细胞张力降低、血管壁僵硬度下降、肾血流量增加,从而发挥抗心室重构、改善心力衰竭症状的作用,目前代表性药物为维立西呱(vericiguat)。VICTORIA研究[256]显示,维立西呱可使 HFrEF患者 CVD相关死亡或首次心力衰竭住院复合终点事件的发生风险降低10%;该研究纳入的5050例患者中包括 507例 eGFR≤30 ml·min-1·(1.73 m2)-1的患者,亚组分析显示,维立西呱带来的心脏获益不受基线 eGFR影响,在肾功能恶化时可能不必下调或停用该药物[257]。
(二) HFmrEF的药物治疗
与 HFrEF的治疗相似,建议使用 β受体阻滞剂联合 ACEI/ARB/ARNI治疗伴有 HFmrEF的透析患者。但这种方法基于有限的一般人群的 HFmrEF治疗数据,因为透析患者的 HFmrEF治疗数据尚缺乏。
推荐意见
54. 对于透析伴HFmrEF患者,建议采取β受体阻滞剂联合ACEI/ARB/ARNI治疗。(推荐程度Ⅱa,证据质量C)
(三) HFpEF的药物治疗
现有证据证实,对于透析伴 HFpEF患者,治疗以控制容量超负荷、改善高血压和心肌缺血等相关因素为主[237]。目前几乎没有证据表明 β受体阻滞剂、 ACEI或 ARB对伴有 HFpEF的透析患者有利,但这些药物常用于其他合并症的管理,如高血压和冠状动脉疾病。近期发表的证据显示,ARNI可改善一般人群 HFpEF的心力衰竭症状及生存率,有利于显著降低肾脏复合终点(eGFR下降≥50%、ESRD及肾因性死亡)风险[258],而另一项在 PD患者中开展的回顾性研究则为 ARNI在透析伴 HFpEF患者中应用的安全性和有效性提供了直接证据 [259]。此外,有间接证据表明 MRA用于伴有 HFpEF的肾功能保留 [eGFR>30 ml· min-1·(1.73 m2)-1]患者可能有利[260],但 MRA用于伴有 HFpEF的透析患者尚存在争议。对于可被严密监测的伴有 HFpEF的透析患者,可在充分评估治疗的潜在风险和获益后,选择 MRA治疗。
推荐意见
55. 对于透析伴 HFpEF患者,治疗以控制容量超负荷、改善高血压和心肌缺血等相关因素为主。(推荐程度Ⅰ,证据质量B)
56. 对于透析伴HFpEF患者,可考虑采用β受体阻滞剂联合 ARNI/ACEI/ARB治疗。(推荐程度Ⅱb,证据质量C)
57. 对于透析伴HFpEF患者,在充分评估治疗潜在风险和获益后,可考虑使用 MRA治疗。(推荐程度Ⅱb,证据质量C)
五、其他管理
(一)心脏植入式电子设备(cardiac implantable electronic devices,CIEDs)
CIEDs包括永久性起搏器、植入式心脏除颤仪(implantable cardiac defibrillators,ICD)和左心室辅助装置(left ventricular assist devices,LVAD),这些设备已广泛应用于一般人群中的心力衰竭患者。多项 RCT显示, CIEDs改善了大部分非 CKD人群的生存率[261]。但是,目前尚缺乏基于 CKD及透析人群的相关 RCT。最近的两项观察性研究表明, CIEDs的获益可能不会延伸到 CKD和透析人群:一项对比了透析患者及非透析患者植入 LVAD死亡率的研究显示, 96%的非透析患者接受 LVAD治疗后存活至出院,中位生存时间接近 6年,但透析患者仅有不到一半存活至出院,中位生存时间仅 16 d[262];另一项纳入了 5877例 CKD(含 ESRD)心力衰竭患者的队列研究分析了使用 ICD进行一级预防与患者死亡及住院风险之间的关系,结果显示,在校正了人口学特征及 CVD危险因素后, ICD组与非 ICD组在全因死亡率方面并无差异,然而 ICD组心力衰竭相关住院率及全因住院率均高于非 ICD组[263]。上述证据提示, CIEDs可能难以为 CKD及透析人群带来生存获益。
推荐意见
58. 对于透析心力衰竭患者,不推荐常规使用心脏植入式电子设备。(推荐程度Ⅲ,证据质量A)
(二)运动康复治疗
对于透析心力衰竭患者,在充分评估心功能的前提下制定个体化的运动康复方案,可增强患者心肺功能、运动耐力、生活质量以及生存率 [264-266],同时也可促进汗液蒸发、分散注意力、调节情绪并改善食欲[267]。HF-ACTION研究[268]显示,在心力衰竭患者中, CKD患者(包括接受透析的患者)进行有氧锻炼具有与无 CKD患者相同的获益。多项 Meta分析[269-270]显示,有氧运动、阻力运动或二者联合的综合运动都可应用于透析患者。考虑到运动可能带来的不良反应,建议 PD患者选择干腹时运动,注意避免对横膈加压,以免引起不适或置管处漏液。对于刚开始 PD治疗的患者,应避免盘腿、下蹲动作,以免腹透管移位。运动后应做隧道口护理,避免出汗导致隧道口感染。
推荐意见
59. 对于透析心力衰竭患者,推荐进行运动康复治疗,以增强运动耐力、改善生活质量、提高生存率。(推荐程度Ⅰ,证据质量A)
利益冲突 所有作者均声明无利益冲突
编写专家组
顾问:余学清(广东省人民医院 /中山大学附属第一医院)
组长:陈江华(浙江大学医学院附属第一医院)、左力(北京大学人民医院)
专家组成员(按姓名汉语拼音排序):
蔡广研(解放军总医院第一医学中心)、陈江华(浙江大学医学院附属第一医院)、陈蕾(西安交通大学第一附属医院)、陈孟华(宁夏医科大学总医院)、陈崴(中山大学附属第一医院)、陈文(海南省肿瘤医院)、陈晓农(上海交通大学附属瑞金医院)、党宗辉(西藏自治区人民医院)、丁小强(复旦大学附属中山医院)、傅君舟(广州市第一人民医院)、付平(四川大学华西医院)、郭志勇(海军军医大学附属长海医院)、韩飞(浙江大学医学院附属第一医院)、郝传明(复旦大学附属华山医院)、何娅妮(陆军特色医学中心)、胡伟新(东部战区总医院)、胡文博(青海省人民医院)、胡昭(山东大学齐鲁医院)、贾强(首都医科大学宣武医院)、姜埃利(天津医科大学第二医院)、蒋更如(上海交通大学医学院附属新华医院)、蒋红利(西安交通大学第一附属医院)、焦军东(哈尔滨医科大学附属第二医院)、李德天(中国医科大学附属盛京医院)、李贵森(四川省人民医院)、李冀军(解放军总医院第四医学中心)、李荣山(山西省人民医院)、李文歌(中日友好医院)、李雪梅(中国医学科学院北京协和医院)、李赟(江西省人民医院)、梁敏(南方医科大学南方医院)、梁馨苓(广东省人民医院)、廖蕴华(广西医科大学第一附属医院)、林洪丽(大连医科大学附属第一医院)、林珊(天津医科大学总医院)、刘必成(东南大学附属中大医院)、刘虹(中南大学湘雅二医院)、刘加明(石河子市人民医院)、刘章锁(郑州大学第一附属医院)、陆晨(新疆医科大学附属第一医院)、伦立德(中国人民解放军空军特色医学中心)、罗惠民(云南省第一人民医院)、毛永辉(北京医院)、倪兆慧(上海交通大学医学院附属仁济医院)、史振伟(北京应急总医院)、孙脊峰(空军军医大学第二附属医院)、孙晶(山东省立医院)、孙林(中南大学湘雅二医院)、童俊容(中国人民解放军南部战区总医院)、万建新(福建医科大学附属第一医院)、王彩丽(内蒙古科技大学包头医学院第一附属医院)、王俭勤(兰州大学第二医院)、王晋文(昆明市延安医院)、王沛(郑州大学第一附属医院)、汪年松(上海交通大学附属第六人民医院)、吴广礼(中国人民解放军联勤保障部队第九八〇医院)、吴永贵(安徽医科大学第一附属医院)、邢昌赢(南京医科大学第一附属医院)、熊飞(武汉市第一医院)、徐钢(华中科技大学同济医学院附属同济医院)、许钟镐(吉林大学第一医院)、闫铁昆(天津医科大学总医院)、杨莉(北京大学第一医院)、杨向东(山东大学齐鲁医院)、姚丽(中国医科大学附属第一医院)、余学清(广东省人民医院 /中山大学附属第一医院)、查艳(贵州大学人民医院)、张春(华中科技大学同济医学院附属协和医院)、张东亮(北京大学国际医院)、张景红(海军第九〇五医院)、张克勤(重庆医科大学附属第二医院)、张萍(浙江大学医学院附属第一医院)、张苏华(上海交通大学医学院附属仁济医院)、赵明辉(北京大学第一医院)、周巧玲(中南大学湘雅医院)、周晓玲(宁夏医科大学总医院)、庄永泽(中国人民解放军联勤保障部队第九〇〇医院)、邹洪斌(吉林大学第二医院)
执笔者:蒋红利 *(西安交通大学第一附属医院)、姚丽(中国医科大学附属第一医院)、陈蕾(西安交通大学第一附属医院)
*为牵头执笔人
参考文献
[1] Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2020, 395(10225): 709-733. DOI: 10.1016/S0140-6736(20)30045-3.
[2] 吕文律, 丁小强, 滕杰, 等. 血液透析和腹膜透析患者死亡原因分析及比较[J]. 肾脏病与透析肾移植杂志, 2010, 19(1): 36-41. DOI: 10.3969/j.issn.1006-298X.2010.01.007.
[3] Wang F, Yang C, Long J, et al. Executive summary for the 2015 Annual Data Report of the China Kidney Disease Network (CK-NET) [J]. Kidney Int, 2019, 95(3): 501-505. DOI: 10.1016/j.kint.2018.11.011.
[4] Romero-González G, Ravassa S, González O, et al. Burden and challenges of heart failure in patients with chronic kidney disease. A call to action[J]. Nefrologia (Engl Ed), 2020, 40(3): 223-236. DOI: 10.1016/j.nefro.2019.10.005.
[5] USRDS. Chapter 8: Cardiovascular disease in patients with ESRD[J]. Am J Kidney Dis, 2018, 71(3 Suppl 1): S417-S432.https://doi.org/10.1053/j.ajkd.2018.01.021.
[6] Hou F, Jiang J, Chen J, et al. China collaborative study on dialysis: a multi-centers cohort study on cardiovascular diseases in patients on maintenance dialysis[J]. BMC Nephrol, 2012, 13: 94. DOI:10.1186/1471-2369-13-94.
[7] Harel Z, Wald R, McArthur E, et al. Rehospitalizations and emergency department visits after hospital discharge in patients receiving maintenance hemodialysis[J]. J Am Soc Nephrol, 2015, 26(12): 3141-3150. DOI:10.1681/ASN.2014060614.
[8] Nichols GA, Ustyugova A, Déruaz-LuyetA, et al. Health care costs by type of expenditure across eGFR stages among patients with and without diabetes, cardiovascular disease, and heart failure[J]. J Am Soc Nephrol, 2020, 31(7): 1594-1601.DOI:10.1681/ASN.2019121308.
[9] 中华医学会心血管病学分会心力衰竭学组, 中国医师协会心力衰竭专业委员会, 中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2018[J]. 中华心血管病杂志, 2018, 46(10): 760-789. DOI: 10.3760/cma.j.issn.0253-3758.2018.10.004.
[10] Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure)[J]. J Am Coll Cardiol, 2005, 46(6): e1-e82. DOI:10.1016/j.jacc.2005.08.022.
[11] Remme WJ, Swedberg K. Guidelines for the diagnosis and treatment of chronic heart failure[J]. Eur Heart J, 2001, 22(17): 1527-1560.DOI: 10.1053/euhj.2001.2783.
[12] Chawla LS, Herzog CA, Costanzo MR, et al. Proposal for a functional classification system of heart failure in patients with end-stage renal disease: proceedings of the acute dialysis quality initiative (ADQI) XI workgroup[J]. J Am Coll Cardiol, 2014, 63(13): 1246-1252. DOI:10.1016/j.jacc.2014.01.020.
[13] Luchner A, Hengstenberg C, L?wel H, et al. Effect of compensated renal dysfunction on approved heart failure markers: direct comparison of brain natriuretic peptide (BNP) and N-terminal pro-BNP[J]. Hypertension, 2005, 46(1): 118-123. DOI: 10.1161/01.HYP.0000170140.36633.8f.
[14] Madias JE. Why recording of an electrocardiogram should be required in every inpatient and outpatient encounter of patients with heart failure[J]. Pacing Clin Electrophysiol, 2011, 34(8): 963-967. DOI:10.1111/j.1540-8159.2011.03131.x.
[15] Khunti K, Squire I, Abrams KR, et al. Accuracy of a 12-leadelectrocardiogram in screening patients with suspected heart failure for open access echocardiography: a systematic review and meta-analysis[J]. Eur J Heart Fail, 2004, 6(5): 571-576. DOI: 10.1016/j.ejheart.2004.03.013.
[16] Costello-Boerrigter LC, Boerrigter G, Redfield MM, et al. Amino-terminal pro-B-type natriuretic peptide and B-type natriuretic peptide inthe general community: determinants and detection of left ventricular dysfunction[J]. J Am Coll Cardiol, 2006, 47(2): 345-353. DOI:10.1016/j.jacc.2005.09.025.
[17] de Lemos JA, McGuire DK, Khera A, et al. Screening the population for left ventricular hypertrophy and left ventricular systolic dysfunction using natriuretic peptides: results from the Dallas Heart Study[J]. Am Heart J, 2009, 157(4): 746-753.e2. DOI: 10.1016/j.ahj.2008.12.017.
[18] Goetze JP, Mogelvang R, Maage L, et al. Plasma pro-B-type natriuretic peptide in the general population: screening for left ventricular hypertrophy and systolic dysfunction[J]. Eur Heart J, 2006, 27(24): 3004-3010. DOI: 10.1093/eurheartj/ehl406.
[19] Ng LL, Loke IW, Davies JE, et al. Community screening for left ventricular systolic dysfunction using plasma and urinary natriuretic peptides[J]. J Am Coll Cardiol, 2005, 45(7): 1043-1050. DOI: 10.1016/j.jacc.2004.12.058.
[20] Richards AM, Doughty R, Nicholls MG, et al. Plasma N-terminal pro-brain natriuretic peptide and adrenomedullin: prognostic utility and prediction of benefit from carvedilol in chronic ischemic left ventricular dysfunction. Australia-New Zealand Heart Failure Group[J]. J Am Coll Cardiol, 2001, 37(7): 1781-1787. DOI: 10.1016/s0735-1097(01)01269-4.
[21] Bugge C, Sether EM, Pahle A, et al. Diagnosing heart failure with NT-proBNP point-of-care testing: lower costs and better outcomes. A decision analytic study[J]. BJGP Open, 2018, 2(3): bjgpopen18X101596. DOI: 10.3399/bjgpopen18X101596.
[22] Takase H, Dohi Y. Kidney function crucially affects B-type natriuretic peptide (BNP), N-terminal proBNP and their relationship[J]. Eur J Clin Invest, 2014, 44(3): 303-308. DOI:10.1111/eci.12234.
[23] Wahl HG, Graf S, Renz H, et al. Elimination of the cardiac natriuretic peptides B-type natriuretic peptide (BNP) and N-terminal proBNP by hemodialysis[J]. Clin Chem, 2004, 50(6): 1071-1074. DOI: 10.1373/clinchem.2003.030692.
[24] Jafri L, Kashif W, Tai J, et al. B-type natriuretic peptide versus amino terminal pro-B type natriuretic peptide: selecting the optimal heart failure marker in patients with impaired kidney function[J]. BMC Nephrol, 2013, 14: 117. DOI: 10.1186/1471-2369-14-117.
[25] Rudiger A, Gasser S, Fischler M, et al. Comparable increase of B-type natriuretic peptide and amino-terminal pro-B-type natriuretic peptide levels in patients with severe sepsis, septic shock, and acute heart failure[J]. Crit Care Med, 2006, 34(8): 2140-2144. DOI: 10.1097/01.CCM.0000229144.97624.90.
[26] Tsutsui H, Isobe M, Ito H, et al. JCS 2017/JHFS2017 Guideline on Diagnosis and Treatment of Acute and Chronic Heart Failure-Digest Version[J]. Circ J, 2019, 83(10): 2084-2184. DOI: 10.1253/circj.CJ-19-0342.
[27] Sandoval Y, Herzog CA, Love SA, et al. Prognostic valueof serial changes in high-sensitivity cardiac troponin I and T over 3 months using reference change values in hemodialysis patients[J]. Clin Chem, 2016, 62(4): 631-638. DOI: 10.1373/clinchem.2015.251835.
[28] Hoppe K, Schwermer K, Klysz P, et al. Cardiac troponin T and hydration status as prognostic markers in hemodialysis patients[J]. Blood Purif, 2015, 40(2): 139-145. DOI: 10.1159/000376603.
[29] Sun J, Axelsson J, Machowska A, et al. Biomarkers of cardiovascular disease and mortality risk in patients with advanced CKD[J]. Clin J Am Soc Nephrol, 2016, 11(7): 1163-1172. DOI: 10.2215/CJN.10441015.
[30] Aimo A, Januzzi JL Jr, Vergaro G, et al. Prognostic value of high-sensitivity troponin T in chronic heart failure: an individual patient data meta-analysis[J]. Circulation, 2018, 137(3): 286-297. DOI: 10.1161/CIRCULATIONAHA.117.031560.
[31] Bayes-Genis A, Zamora E, de Antonio M, et al. Soluble ST2 serum concentration and renal function in heart failure[J]. J Card Fail, 2013, 19(11): 768-775. DOI: 10.1016/j.cardfail.2013.09.005.
[32] Mueller T, Gegenhuber A, Kronabethleitner G, et al. Plasma concentrations of novel cardiac biomarkers before and after hemodialysis session[J]. Clin Biochem, 2015, 48(16-17): 1163-1166. DOI: 10.1016/j.clinbiochem.2015.07.031.
[33] Aldous SJ, Richards AM, Troughton R, et al. ST2 has diagnostic and prognostic utility for all-cause mortality and heart failure in patients presenting to the emergency department with chest pain[J]. J Card Fail, 2012, 18(4): 304-310. DOI: 10.1016/j.cardfail.2012.01.008.
[34] Lok DJ, Van Der Meer P, de la Porte PW, et al. Prognostic value of galectin-3, a novel marker of fibrosis, in patients with chronic heart failure: data from the DEAL-HF study[J]. Clin Res Cardiol, 2010, 99(5): 323-328. DOI: 10.1007/s00392-010-0125-y.
[35] Gurel OM, Yilmaz H, Celik TH, et al. Galectin-3 as a new biomarker of diastolic dysfunction in hemodialysis patients[J]. Herz, 2015, 40(5): 788-794. DOI: 10.1007/s00059-015-4303-6.
[36] Wollert KC, Kempf T, Wallentin L. Growth differentiation factor 15 as a biomarker in cardiovascular disease[J]. Clin Chem,2017, 63(1):140-151. DOI:10.1373/clinchem.2016.255174.
[37] Hrynchyshyn N, Jourdain P, Desnos M, et al. Galectin-3: a new biomarker for the diagnosis, analysis and prognosis of acute and chronic heart failure[J]. Arch Cardiovasc Dis, 2013, 106(10): 541-546. DOI: 10.1016/j.acvd.2013.06.054.
[38] Ghashghaei R, Arbit B, Maisel AS. Current and novel biomarkers in heart failure: bench to bedside[J]. Curr Opin Cardiol, 2016, 31(2): 191-195. DOI:10.1097/HCO.0000000000000254.
[39] Park M, Hsu CY, Li Y, et al. Associations between kidney function and subclinical cardiac abnormalities in CKD[J]. J Am Soc Nephrol, 2012, 23(10): 1725-1734. DOI: 10.1681/ASN.2012020145.
[40] Foley RN, Parfrey PS, Kent GM, et al. Serial change in echocardiographic parameters and cardiac failure in end-stage renal disease[J]. J Am Soc Nephrol, 2000, 11(5): 912-916. DOI:10.1681/ASN.V115912.
[41] Hickson LJ, Negrotto SM, Onuigbo M, et al. Echocardiography criteria for structural heart disease in patients with end-stage renal disease initiating hemodialysis[J]. J Am Coll Cardiol, 2016, 67(10): 1173-1182. DOI:10.1016/j.jacc.2015.12.052.
[42] K/DOQI Workgroup. K/DOQI clinical practice guidelines for cardiovascular disease in dialysis patients[J]. Am J Kidney Dis,2005, 45(4 Suppl 3): S1-S153.
[43] Romero J, Xue X, Gonzalez W, et al. CMR imaging assessing viability in patients with chronic ventricular dysfunction due to coronary artery disease: a meta-analysis of prospective trials[J]. JACC Cardiovasc Imaging, 2012, 5(5): 494-508. DOI: 10.1016/j.jcmg.2012.02.009.
[44] Selvanayagam JB, Kardos A, Francis JM, et al. Value of delayed-enhancement cardiovascular magnetic resonance imaging in predicting myocardial viability after surgical revascularization[J]. Circulation, 2004, 110(12): 1535-1541. DOI:10.1161/01.CIR.0000142045.22628.74.
[45] Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-c184. DOI: 10.1159/000339789.
[46] Bahrainwala JZ, Leonberg-Yoo AK, Rudnick MR. Use of radiocontrast agents in CKD and ESRD[J]. Semin Dial, 2017, 30(4): 290-304. DOI: 10.1111/sdi.12593.
[47] Stromp TA, Spear TJ, Holtkamp RM, et al. Quantitative gadolinium-free cardiac fibrosis imaging inend stage renal disease patients reveals a longitudinal correlation with structural and functional decline[J]. Sci Rep, 2018, 8(1): 16972. DOI: 10.1038/s41598-018-35394-4.
[48] Kott J, Reichek N, Butler J, et al. Cardiac imaging in dialysis patients[J]. Kidney Med, 2020, 2(5): 629-638. DOI: 10.1016/j.xkme.2020.05.010.
[49] Budoff MJ, Dowe D, Jollis JG, et al. Diagnostic performance of 64-multidetector row coronary computed tomographic angiography for evaluation of coronary artery stenosis in individuals without known coronary artery disease: results from the prospective multicenter ACCURACY (Assessment by Coronary Computed Tomographic Angiography of Individuals Undergoing Invasive Coronary Angiography) trial[J]. J Am Coll Cardiol, 2008, 52(21): 1724-1732. DOI: 10.1016/j.jacc.2008.07.031.
[50] de Bie MK, Buiten MS, Gaasbeek A, et al. CT coronary angiography is feasible for the assessment of coronary artery diseasein chronic dialysis patients, despite high average calcium scores[J]. PLoS One, 2013, 8(7): e67936. DOI: 10.1371/journal.pone.0067936.
[51] Spertus J, Peterson E, Conard MW, et al. Monitoring clinical changes in patients with heart failure: a comparison of methods[J]. Am Heart J, 2005, 150(4): 707-715. DOI: 10.1016/j.ahj.2004.12.010.
[52] Mishra RK, Yang W, Roy J, et al. Kansas city cardiomyopathy questionnaire score is associated with incident heart failure hospitalization in patients with chronic kidney disease without previously diagnosed heart failure: chronic renal insufficiency cohort study[J]. Circ Heart Fail, 2015,8(4): 702-708. DOI: 10.1161/CIRCHEARTFAILURE.115.002097.
[53] Roehm B, Gulati G, Weiner DE. Heart failure management in dialysis patients: many treatment options with no clear evidence[J]. Semin Dial, 2020, 33(3): 198-208. DOI: 10.1111/sdi.12878.
[54] Antlanger M, Aschauer S, Kopecky C, et al. Heart failure with preserved and reduced ejection fraction in hemodialysis patients: prevalence, disease prediction and prognosis[J]. Kidney Blood Press Res, 2017, 42(1): 165-176. DOI: 10.1159/000473868.
[55] Wang AY, Wang M, Lam CW, et al. Heart failure with preserved or reduced ejection fraction in patients treated with peritoneal dialysis[J]. Am J Kidney Dis, 2013, 61(6): 975-983. DOI: 10.1053/j.ajkd.2012.12.030.
[56] Nagueh SF, Smiseth OA, Appleton CP, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. J Am Soc Echocardiogr, 2016, 29(4): 277-314. DOI: 10.1016/j.echo.2016.01.011.
[57] 廖玉华, 杨杰孚, 张健, 等. 舒张性心力衰竭诊断和治疗专家共识[J]. 临床心血管病杂志, 2020, 36(1): 1-10. DOI: 10.13201/j.issn.1001-1439.2020.01.001.
[58] Marwick TH. The role of echocardiography in heart failure[J]. J Nucl Med, 2015, 56 Suppl 4: 31S-38S. DOI: 10.2967/ jnumed.114.150433.
[59] Redfield MM. Heart failure with preserved ejection fraction[J]. N Engl J Med, 2016, 375(19): 1868-1877. DOI: 10.1056/ NEJMcp1511175.
[60] Mueller C, McDonald K, de Boer RA, et al. Heart failure association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations[J]. Eur J Heart Fail, 2019, 21(6): 715-731. DOI: 10.1002/ejhf.1494.
[61] Paulus WJ, Tsch?pe C, Sanderson JE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology[J]. Eur Heart J, 2007, 28(20): 2539-2550. DOI: 10.1093/eurheartj/ehm037.
[62] Ezekowitz JA, O′Meara E, MearaE, et al. 2017 Comprehensive Update of the Canadian Cardiovascular Society Guidelines for the Management of Heart Failure[J]. Can J Cardiol, 2017, 33(11): 1342-1433. DOI: 10.1016/j.cjca.2017.08.022.
[63] Messerli FH, Rimoldi SF, Bangalore S. The transition from hypertension to heart failure: contemporary update[J]. JACC Heart Fail, 2017, 5(8): 543-551. DOI: 10.1016/j.jchf.2017.04.012.
[64] Muntner P, Anderson A, Charleston J, et al. Hypertension awareness, treatment, and control in adults with CKD: results from the Chronic Renal Insufficiency Cohort (CRIC) Study[J]. Am J Kidney Dis, 2010, 55(3): 441-451. DOI: 10.1053/j.ajkd.2009.09.014.
[65] Kearney PM, Whelton M, Reynolds K, et al. Global burden of hypertension: analysis of worldwide data[J]. Lancet, 2005, 365(9455): 217-223. DOI: 10.1016/S0140-6736(05)17741-1.
[66] Schreiber BD. Congestive heart failure in patients with chronic kidney disease and on dialysis[J]. Am J Med Sci, 2003, 325(4): 179-193. DOI: 10.1097/00000441-200304000-00004.
[67] Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelinesfor the management of arterial hypertension[J]. Eur Heart J, 2018, 39(33): 3021-3104. DOI: 10.1093/eurheartj/ehy339.
[68] Wright JT Jr, Williamson JD, Whelton PK, et al. Arandomized trial of intensive versus standard blood-pressure control[J]. N Engl J Med, 2015, 373(22): 2103-2116. DOI: 10.1056/NEJMoa1511939.
[69] Cheung AK, Rahman M, Reboussin DM, et al. Effects of intensive BP control in CKD[J]. J Am Soc Nephrol, 2017, 28(9): 2812-2823. DOI: 10.1681/ASN.2017020148.
[70] Sarafidis P, Loutradis C, Ortiz A, et al. Blood pressure targets in patients with chronic kidney disease: MDRD and AASK now confirming SPRINT[J]. Clin Kidney J, 2020, 13(3): 287-290. DOI: 10.1093/ckj/sfaa015.
[71] 中国医师协会肾脏病医师分会血液透析充分性协作组. 中国血液透析充分性临床实践指南[J]. 中华医学杂志, 2015, 95(34): 2748-2753. DOI: 10.3760/cma.j.issn.0376-2491.2015.34.004.
[72] 中国医师协会肾脏内科医师分会, 中国中西医结合学会肾脏疾病专业委员会. 中国肾性高血压管理指南2016(简版)[J]. 中华医学杂志, 2017, 97(20): 1547-1555. DOI: 10.3760/cma.j.issn.0376-2491.2017.20.010.
[73] 中国高血压防治指南修订委员会, 高血压联盟(中国) , 中华医学会心血管病学分会, 等. 中国高血压防治指南 (2018年修订版 )[J]. 中国心血管杂志, 2019, 24(1): 24-56. DOI: 10.3969/j.issn.1007-5410.2019.01.002.
[74] Wang AY, Brimble KS, Brunier G, et al. ISPD Cardiovascular and Metabolic Guidelines in Adult Peritoneal Dialysis Patients Part I - Assessment and management of various cardiovascular risk factors[J]. Perit Dial Int, 2015, 35(4): 379-387. DOI: 10.3747/pdi.2014.00279.
[75] Kashihara N, Kohsaka S, Kanda E, et al. Hyperkalemia in real-world patients under continuous medical care in Japan[J]. Kidney Int Rep, 2019, 4(9): 1248-1260. DOI: 10.1016/j.ekir.2019.05.018.
[76] Supasyndh O, Wang J, Hafeez K, et al. Efficacy and safety of sacubitril/valsartan (LCZ696) compared with olmesartan in elderly Asian patients (≥65 years) with systolic hypertension[J]. Am J Hypertens, 2017, 30(12): 1163-1169. DOI: 10.1093/ajh/hpx111.
[77] Huo Y, Li W, Webb R, et al. Efficacy and safety of sacubitril/valsartan compared with olmesartan in Asian patients with essential hypertension: a randomized, double-blind, 8-week study[J]. J Clin Hypertens (Greenwich), 2019, 21(1): 67-76. DOI: 10.1111/jch.13437.
[78] Geng Q, Yan R, Wang Z, et al. Effects of LCZ696 (sacubitril/valsartan) on blood pressure in patients with hypertension: a meta-analysis of randomized controlled trials[J]. Cardiology, 2020, 145(9): 589-598. DOI: 10.1159/000507327.
[79] Wang B, Wang GH, Ding XX, et al. Effects of sacubitril/valsartan on resistant hypertension and myocardial work in hemodialysis patients[J]. J Clin Hypertens (Greenwich), 2022, 24(3): 300-308. DOI: 10.1111/jch.14422.
[80] Ishiyama Y, Hoshide S, Mizuno H, et al. Constipation-induced pressor effects as triggers for cardiovascular events[J]. J Clin Hypertens (Greenwich), 2019, 21(3): 421-425. DOI: 10.1111/jch.13489.
[81] Sumida K, Yamagata K, Kovesdy CP. Constipation in CKD[J]. Kidney Int Rep, 2020, 5(2): 121-134. DOI: 10.1016/j.ekir.2019.11.002.
[82] Zuvela J, Trimingham C, Le Leu R, et al. Gastrointestinal symptoms in patients receiving dialysis: a systematic review[J]. Nephrology(Carlton), 2018, 23(8): 718-727. DOI: 10.1111/nep.13243.
[83] Kosmadakis G, Albaret J, Da Costa Correia E, et al. Constipation in peritoneal dialysis patients[J]. Perit Dial Int, 2019, 39(5): 399-404. DOI: 10.3747/pdi.2018.00169.
[84] Kelly JT, Palmer SC, Wai SN, et al. Healthy dietary patterns and risk of mortality and ESRD in CKD: a meta-analysis of cohort studies[J]. Clin J Am Soc Nephrol, 2017, 12(2): 272-279. DOI: 10.2215/CJN.06190616.
[85] Ford AC, Moayyedi P, Lacy BE, et al. American College of Gastroenterology monograph on the management of irritable bowel syndrome and chronic idiopathic constipation[J]. Am J Gastroenterol, 2014, 109 Suppl 1: S2-S26; quiz S27. DOI: 10.1038/ajg.2014.187.
[86] Sueyoshi M, Fukunaga M, Mei M, et al. Effects of lactuloseon renal function and gut microbiota in adenine-induced chronic kidney disease rats[J]. Clin Exp Nephrol, 2019, 23(7): 908-919. DOI: 10.1007/s10157-019-01727-4.
[87] Nanto-Hara F, Kanemitsu Y, Fukuda S, et al. The guanylate cyclase C agonist linaclotide ameliorates the gut-cardio-renalaxis in anadenine-induced mouse model of chronic kidney disease[J]. Nephrol Dial Transplant, 2020, 35(2): 250-264. DOI: 10.1093/ndt/gfz126.
[88] Mishima E, Fukuda S, Shima H, et al. Alteration of the intestinal environment by lubiprostone is associated with amelioration of adenine-induced CKD[J]. J Am Soc Nephrol, 2015, 26(8): 1787-1794. DOI: 10.1681/ASN.2014060530.
[89] Harnett JD, Foley RN, Kent GM, et al. Congestive heart failurein dialysis patients: prevalence, incidence, prognosis and risk factors[J]. Kidney Int, 1995, 47(3): 884-890. DOI: 10.1038/ki.1995.132.
[90] Li Y, Huang T, Zheng Y, et al. Folic acid supplementation and the risk of cardiovascular diseases: a meta-analysis of randomized controlled trials[J]. J Am Heart Assoc, 2016, 5(8): e003768. DOI: 10.1161/JAHA.116.003768.
[91] Held C, Gerstein HC, Yusuf S, et al. Glucose levels predict hospitalization for congestive heart failure in patients at high cardiovascular risk[J]. Circulation, 2007, 115(11): 1371-1375. DOI: 10.1161/CIRCULATIONAHA.106.661405.
[92] Cozzolino M, Mangano M, Stucchi A, et al. Cardiovascular disease in dialysis patients[J]. Nephrol Dial Transplant, 2018, 33 suppl_3: iii28-iii34. DOI: 10.1093/ndt/gfy174.
[93] Larsson SC, Orsini N, Wolk A. Alcohol consumption and riskof heart failure: a dose-response meta-analysis of prospective studies[J]. Eur J Heart Fail, 2015, 17(4): 367-373. DOI: 10.1002/ejhf.228.
[94] Kenchaiah S, Evans JC, Levy D, et al. Obesity and the risk of heart failure[J]. N Engl J Med, 2002, 347(5): 305-313. DOI: 10.1056/NEJMoa020245.
[95] 中国成人血脂异常防治指南修订联合委员会. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016, 31(10): 937-950. DOI: 10.3969/j.issn.1000-3614.2016.10.001.
[96] Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC/AHAguideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College ofCardiology/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2014, 63(25 Pt B): 2889-2934. DOI: 10.1016/j.jacc.2013.11.002.
[97] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南 (2017年版)[J]. 中华糖尿病杂志, 2018, 10(1): 4-67. DOI: 10.3760/cma.j.issn.1674-5809.2018.01.003.
[98] Bhatti NK, Karimi Galougahi K, Paz Y, et al. Diagnosis and management of cardiovascular disease in advanced and end-stage renal disease[J]. J Am Heart Assoc, 2016, 5(8): e003648. DOI: 10.1161/JAHA.116.003648.
[99] Mohamed BA, Schnelle M, Khadjeh S, et al. Molecular and structural transition mechanisms in long-term volume overload[J]. Eur J Heart Fail, 2016, 18(4): 362-371. DOI: 10.1002/ejhf.465.
[100] Glassock RJ, Pecoits-Filho R, Barberato SH. Left ventricular mass in chronic kidney disease and ESRD[J]. Clin J Am Soc Nephrol, 2009, 4 Suppl 1: S79-S91. DOI: 10.2215/CJN.04860709.
[101] Ozkahya M, Ok E, Cirit M, et al. Regression of left ventricular hypertrophy in haemodialysis patients by ultrafiltration and reduced salt intake without antihypertensive drugs[J]. Nephrol Dial Transplant, 1998, 13(6): 1489-1493. DOI: 10.1093/ndt/13.6.1489.
[102] Cozzolino M, Galassi A, Pivari F, et al. The cardiovascular burden in end-stage renal disease[J]. Contrib Nephrol, 2017, 191: 44-57. DOI: 10.1159/000479250.
[103] Cerini C, Dou L, Anfosso F, et al. P-cresol, a uremic retentionsolute, alters the endothelial barrier function in vitro[J]. Thromb Haemost, 2004, 92(1): 140-150. DOI: 10.1160/TH03-07-0491.
[104] Ying Y, Yang K, Liu Y, et al. A uremic solute, P-cresol, inhibits the proliferation of endothelial progenitor cells via the p38 pathway[J]. Circ J, 2011, 75(9): 2252-2259. DOI: 10.1253/circj.cj-11-0046.
[105] Chitalia VC, Shivanna S, Martorell J, et al. Uremic serum and solutes increase post-vascular interventional thrombotic risk through altered stability of smooth muscle cell tissue factor[J]. Circulation, 2013, 127(3): 365-376. DOI: 10.1161/CIRCULATIONAHA.112.118174.
[106] Kamiński TW, Pawlak K, Karbowska M, et al. Indoxyl sulfate-the uremic toxin linking hemostatic system disturbances with the prevalence of cardiovascular disease in patients with chronic kidney disease[J]. BMC Nephrol, 2017, 18(1): 35. DOI: 10.1186/s12882-017-0457-1.
[107] Barisione C, Ghigliotti G, Canepa M, et al. Indoxyl sulfate: a candidate target for the prevention and treatment of cardiovascular disease in chronic kidney disease[J]. Curr Drug Targets, 2015, 16(4): 366-372. DOI: 10.2174/1389450116666141230114500.
[108] Cao XS, Chen J, Zou JZ, et al. Association of indoxyl sulfate with heart failure among patients on hemodialysis[J]. Clin J Am Soc Nephrol, 2015, 10(1): 111-119. DOI: 10.2215/CJN.04730514.
[109] Hayashi T, Yamashita T, Watanabe H, et al. Gut microbiomeand plasma microbiome-related metabolites in patients with decompensated and compensated heart failure[J]. Circ J, 2018, 83(1): 182-192. DOI: 10.1253/circj.CJ-18-0468.
[110] Jin M, Qian Z, Yin J, et al. The role of intestinal microbiota in cardiovascular disease[J]. J Cell Mol Med, 2019, 23(4): 2343-2350. DOI: 10.1111/jcmm.14195.
[111] Edwards NC, Moody WE, Chue CD, et al. Defining the natural history of uremic cardiomyopathy in chronic kidney disease: the role of cardiovascular magnetic resonance[J]. JACC Cardiovasc Imaging, 2014, 7(7): 703-714. DOI: 10.1016/j.jcmg.2013.09.025.
[112] Rangaswami J, McCullough PA. Heart failure in end-stage kidney disease: pathophysiology, diagnosis, and therapeutic strategies[J]. Semin Nephrol, 2018, 38(6): 600-617. DOI: 10.1016/j.semnephrol.2018.08.005.
[113] Van Biesen W, Lameire N, Verbeke F, et al. Residual renal function and volume status in peritoneal dialysis patients: a conflict ofinterest?[J]. J Nephrol, 2008, 21(3): 299-304.
[114] Liao CT, Chen YM, Shiao CC, et al. Rate of decline of residual renal function is associated with all-cause mortality and technique failure in patients on long-term peritoneal dialysis[J]. Nephrol Dial Transplant, 2009, 24(9): 2909-2914. DOI: 10.1093/ndt/gfp056.
[115] Liu Y, Ma X, Zheng J, et al. Effects of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers on cardiovascular events and residual renal function in dialysis patients: a meta-analysis of randomised controlled trials[J]. BMC Nephrol, 2017, 18(1): 206. DOI: 10.1186/s12882-017-0605-7.
[116] Kalantar-ZadehK, Abbott KC, Kronenberg F, et al. Epidemiology of dialysis patients and heart failure patients[J]. Semin Nephrol, 2006, 26(2): 118-133. DOI: 10.1016/j.semnephrol.2005.09.005.
[117] Haugen E, Nath KA. The involvement of oxidative stress in the progression of renal injury[J]. Blood Purif, 1999, 17(2-3): 58-65. DOI: 10.1159/000014377.
[118] Wilcox CS. Asymmetric dimethylarginine and reactive oxygen species: unwelcome twin visitors to the cardiovascular and kidney disease tables[J]. Hypertension, 2012, 59(2): 375-381. DOI: 10.1161/HYPERTENSIONAHA.111.187310.
[119] Okamura K, Nakagama Y, Takeda N, et al. Therapeutic targeting of mitochondrial ROS ameliorates murine model of volume overload cardiomyopathy[J]. J Pharmacol Sci, 2019, 141(1): 56-63. DOI: 10.1016/j.jphs.2019.09.005.
[120] Xu Q, Dalic A, Fang L, et al. Myocardial oxidative stress contributes to transgenic β2-adrenoceptor activation-induced cardiomyopathy and heart failure[J]. Br J Pharmacol, 2011, 162(5): 1012-1028. DOI: 10.1111/j.1476-5381.2010.01043.x.
[121] Faul C, Amaral AP, Oskouei B, et al. FGF23 induces left ventricular hypertrophy[J]. J Clin Invest, 2011, 121(11): 4393-4408. DOI: 10.1172/JCI46122.
[122] Scialla JJ, Xie H, Rahman M, et al. Fibroblast growth factor-23 and cardiovascular events in CKD[J]. J Am Soc Nephrol, 2014, 25(2): 349-360. DOI: 10.1681/ASN.2013050465.
[123] Hsu HJ, Wu MS. Fibroblast growth factor 23: a possible cause of left ventricular hypertrophy in hemodialysis patients[J]. Am J Med Sci, 2009, 337(2): 116-122. DOI: 10.1097/MAJ.0b013e3181815498.
[124] Ezumba I, Quarles LD, Kovesdy CP. [FGF23 and theheart][J]. G Ital Nefrol, 2014, 31(6): gin/31.6.12.
[125] Ter Maaten JM, Voors AA, Damman K, et al. Fibroblast growth factor 23 is related to profiles indicating volume overload, poor therapy optimization and prognosis in patients with new-onset and worsening heart failure[J]. Int J Cardiol, 2018, 253: 84-90. DOI: 10.1016/j.ijcard.2017.10.010.
[126] Fujii H, Joki N. Mineral metabolism and cardiovascular disease in CKD[J]. Clin Exp Nephrol, 2017, 21 Suppl 1: 53-63. DOI: 10.1007/s10157-016-1363-8.
[127] Chen S, Law CS, Grigsby CL, et al. Cardiomyocyte-specific deletion of the vitamin D receptor gene results in cardiac hypertrophy[J]. Circulation, 2011, 124(17): 1838-1847. DOI: 10.1161/CIRCULATIONAHA.111.032680.
[128] Choi SR, Lim JH, Kim MY, et al. Cinacalcet improves endothelial dysfunction and cardiac hypertrophy in patients on hemodialysis with secondary hyperparathyroidism[J]. Nephron Clin Pract, 2012, 122(1-2): 1-8. DOI: 10.1159/000347145.
[129] Erratum: Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group. KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease - Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl. 2017;7:1 - 59[J]. Kidney Int Suppl (2011), 2017, 7(3): e1. DOI: 10.1016/j.kisu.2017.10.001.
[130] 刘志红, 李贵森. 中国慢性肾脏病矿物质和骨异常诊治指南[M]. 第 1版. 北京: 人民卫生出版社, 2019.
[131] Foley RN, Parfrey PS, Harnett JD, et al. The impact of anemia on cardiomyopathy, morbidity, and and mortality in end-stage renal disease[J]. Am J Kidney Dis, 1996, 28(1): 53-61. DOI: 10.1016/s0272-6386(96)90130-4.
[132] Io H, Aizawa M, Funabiki K, et al. Impact of anaemia treatment for left ventricular remodelling prior to initiation of dialysis in chronic kidney disease patients: efficacy and stability of long acting erythropoietin stimulating agents[J]. Nephrology (Carlton), 2015, 20 Suppl 4: 7-13. DOI: 10.1111/nep.12640.
[133] Silverberg DS, Wexler D, Iaina A, et al. Anemia, chronic renal disease and congestive heart failure--the cardio renal anemia syndrome: the need for cooperation between cardiologists and nephrologists[J]. Int Urol Nephrol, 2006, 38(2): 295-310. DOI: 10.1007/s11255-006-0064-8.
[134] Besarab A, Chernyavskaya E, Motylev I, et al. Roxadustat(FG-4592): correction of anemia in incident dialysis patients[J]. J Am Soc Nephrol, 2016, 27(4): 1225-1233. DOI: 10.1681/ASN.2015030241.
[135] Chen N, Hao C, Peng X, et al. Roxadustat for anemia in patients with kidney disease not receiving dialysis[J]. N Engl J Med, 2019,381(11): 1001-1010. DOI: 10.1056/NEJMoa1813599.
[136] Kidney Disease: Improving Global Outcomes (DKIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease[J]. Kidney Int Suppl, 2012, 2: 279-335. https://www.sciencedirect.com/journal/kidney-international-supplements/vol/2/issue/4.
[137] Shepshelovich D, Rozen-Zvi B, Avni T, et al. Intravenous versusoral iron supplementation for the treatment of anemia in CKD: an updated systematic review and meta-analysis[J]. Am J Kidney Dis, 2016, 68(5): 677-690. DOI: 10.1053/j.ajkd.2016.04.018.
[138] Malik J. Heart disease in chronic kidney disease-review of the mechanisms and the role of dialysis access[J]. J Vasc Access, 2018, 19(1): 3-11. DOI: 10.5301/jva.5000815.
[139] Reddy Y, Obokata M, Dean PG, et al. Long-term cardiovascular changes following creation of arteriovenous fistula in patients with end stage renal disease[J]. Eur Heart J, 2017, 38(24): 1913-1923. DOI: 10.1093/eurheartj/ehx045.
[140] Movilli E, Viola BF, Brunori G, et al. Long-term effects of arteriovenous fistula closure on echocardiographic functional and structural findings in hemodialysis patients: a prospective study[J]. Am J Kidney Dis,2010, 55(4): 682-689. DOI: 10.1053/j.ajkd.2009.11.008.
[141] Wasse H, Singapuri MS. High-output heart failure: how to define it, when to treat it, and how to treat it[J]. Semin Nephrol, 2012,32(6): 551-557. DOI: 10.1016/j.semnephrol.2012.10.006.
[142] 潘明明, 高民, 俞济荣, 等. 环阻法内瘘缩窄术治疗动静脉内瘘高流量致高输出量心力衰竭一例[J]. 中华肾脏病杂志, 2019, 35(7): 532-533. DOI: 10.3760/cma.j.issn.1001-7097.2019.07.009.
[143] 王嫣然, 张慧丽, 范鸿儒, 等. 以恶心、呕吐为首发表现的高流量动静脉内瘘1例[J]. 中华肾脏病杂志, 2022, 38(3): 232-234. DOI: 10.3760/cma.j.cn441217-20210406-00034.
[144] Foley RN, Curtis BM, Randell EW, et al. Left ventricular hypertrophy in new hemodialysis patients without symptomatic cardiac disease[J]. Clin J Am Soc Nephrol, 2010, 5(5): 805-813. DOI: 10.2215/CJN.07761109.
[145] Wang IK, Lu CY, Lin CL, et al. Comparison of the risk of de novo cardiovascular disease between hemodialysis and peritoneal dialysis in patients with end-stage renal disease[J]. Int J Cardiol, 2016, 218: 219-224. DOI: 10.1016/j.ijcard.2016.05.036.
[146] Sun CY, Sung JM, Wang JD, et al. A comparison of the risk of congestive heart failure-related hospitalizations in patients receiving hemodialysis and peritoneal dialysis -A retrospective propensity score-matched study[J]. PLoS One, 2019, 14(10): e0223336. DOI: 10.1371/journal.pone.0223336.
[147] McIntyre CW, Burton JO, Selby NM, et al. Hemodialysis-induced cardiac dysfunction is associated with an acute reduction in global and segmental myocardial blood flow[J]. Clin J Am Soc Nephrol, 2008, 3(1): 19-26. DOI: 10.2215/CJN.03170707.
[148] Dasselaar JJ, Slart RH, Knip M, et al. Haemodialysis is associated with a pronounced fall in myocardial perfusion[J]. Nephrol Dial Transplant, 2009, 24(2): 604-610. DOI: 10.1093/ndt/gfn501.
[149] Sniderman AD, Solhpour A, Alam A, et al. Cardiovascular death in dialysis patients: lessons we can learn from AURORA[J]. Clin J Am Soc Nephrol, 2010, 5(2): 335-340. DOI: 10.2215/CJN.06300909.
[150] Tian Y, Xie X, Xiang S, et al. Risk factors and outcomes of high peritonitis rate in continuous ambulatory peritoneal dialysis patients: a retrospective study[J]. Medicine (Baltimore), 2016, 95(49): e5569. DOI: 10.1097/MD.0000000000005569.
[151] Agarwal R, Bouldin JM, Light RP, et al. Inferior vena cava diameter and left atrial diameter measure volume but not dry weight[J]. Clin J Am Soc Nephrol, 2011, 6(5): 1066-1072. DOI: 10.2215/CJN.09321010.
[152] Siriopol D, Hogas S, Voroneanu L, et al. Predicting mortality in haemodialysis patients: a comparison between lung ultrasonography, bioimpedance data and echocardiography parameters[J]. Nephrol Dial Transplant, 2013, 28(11): 2851-2859. DOI: 10.1093/ndt/gft260.
[153] Enia G, Torino C, Panuccio V, et al. Asymptomatic pulmonary congestion and physical functioning in hemodialysis patients[J]. ClinJ Am Soc Nephrol, 2013, 8(8): 1343-1348. DOI: 10.2215/CJN.11111012.
[154] Machek P, Jirka T, Moissl U, et al. Guided optimization of fluid status in haemodialysis patients[J]. Nephrol Dial Transplant, 2010, 25(2): 538-544. DOI: 10.1093/ndt/gfp487.
[155] Scotland G, Cruickshank M, Jacobsen E, et al. Multiple-frequency bioimpedance devices for fluid management in people with chronic kidney disease receiving dialysis: a systematic review and economic evaluation[J]. Health Technol Assess, 2018, 22(1): 1-138. DOI: 10.3310/hta22010.
[156] Siriopol D, Onofriescu M, Voroneanu L, et al. Dry weight assessment by combined ultrasound and bioimpedance monitoring in low cardiovascular risk hemodialysis patients: a randomized controlled trial[J]. Int Urol Nephrol, 2017, 49(1): 143-153. DOI: 10.1007/s11255-016-1471-0.
[157] Barth C, Boer W, Garzoni D, et al. Characteristics of hypotension-prone haemodialysis patients: is there a critical relative blood volume?[J]. Nephrol Dial Transplant, 2003, 18(7): 1353-1360. DOI: 10.1093/ndt/gfg171.
[158] Agarwal R, Alborzi P, Satyan S, et al. Dry-weight reduction in hypertensive hemodialysis patients (DRIP): a randomized, controlled trial[J]. Hypertension, 2009, 53(3): 500-507. DOI: 10.1161/HYPERTENSIONAHA.108.125674.
[159] Raimann J, Liu L, Tyagi S, et al. A fresh look at dry weight[J]. Hemodial Int, 2008, 12(4): 395-405. DOI: 10.1111/j.1542 - 4758.2008.00302.x.
[160] 中国医师协会肾脏内科医师分会, 中国中西医结合学会肾脏疾病专业委员会营养治疗指南专家协作组. 中国慢性肾脏病营养治疗临床实践指南(2021版)[J]. 中华医学杂志, 2021, 101(8): 539-559. DOI: 10.3760/cma.j.cn112137-20201211-03338.
[161] Eknoyan G, Beck GJ, Cheung AK, et al. Effect of dialysis dose and membrane flux in maintenance hemodialysis[J]. N Engl J Med, 2002, 347(25): 2010-2019. DOI: 10.1056/NEJMoa021583.
[162] Palmer SC, Rabindranath KS, Craig JC, et al. High-flux versus low-flux membranes for end-stage kidney disease[J]. Cochrane Database Syst Rev, 2012, 2012(9): CD005016. DOI: 10.1002/14651858.CD005016.pub2.
[163] Canaud B, Bowry SK. Emerging clinical evidence on online hemodiafiltration: does volume of ultrafiltration matter?[J]. Blood Purif, 2013, 35(1-3): 55-62. DOI: 10.1159/000345175.
[164] Ohtake T, Oka M, Ishioka K, et al. Cardiovascular protective effects of on-line hemodiafiltration: comparison with conventional hemodialysis[J]. Ther Apher Dial, 2012, 16(2): 181-188. DOI: 10.1111/j.1744-9987.2011.01042.x.
[165] Ok E, Asci G, Toz H, et al. Mortality and cardiovascular events in online haemodiafiltration (OL-HDF) compared with high-flux dialysis: results from the Turkish OL-HDF Study[J]. Nephrol Dial Transplant, 2013, 28(1): 192-202. DOI: 10.1093/ndt/gfs407.
[166] Kes P. Biocompatibility of dialysis membrane[J]. Acta Med Croatica, 1999, 53(1): 29-40.
[167] Basile C, Lomonte C, Vernaglione L, et al. The relationship between the flow of arteriovenous fistula and cardiac output in haemodialysis patients[J]. Nephrol Dial Transplant, 2008, 23(1): 282-287. DOI: 10.1093/ndt/gfm549.
[168] Wijnen E, Keuter XH, Planken NR, et al. The relation between vascular access flow and different types of vascular access with systemic hemodynamics in hemodialysis patients[J]. Artif Organs, 2005, 29(12): 960-964. DOI: 10.1111/j.1525-1594.2005.00165.x.
[169] 中国医院协会血液净化中心分会血管通路工作组. 中国血液透析用血管通路专家共识(第2版)[J]. 中国血液净化, 2019, 18(6): 365-381. DOI: 10.3969/j.issn.1671-4091.2019.06.001.
[170] McCullough PA, Chan CT, Weinhandl ED, et al. Intensive hemodialysis, left ventricular hypertrophy, and cardiovascular disease[J]. Am J Kidney Dis, 2016, 68(5S1): S5-S14. DOI: 10.1053/j.ajkd.2016.05.025.
[171] Nesrallah GE, Lindsay RM, Cuerden MS, et al. Intensive hemodialysis associates with improved survival compared with conventional hemodialysis[J]. J Am Soc Nephrol, 2012, 23(4): 696-705. DOI: 10.1681/ASN.2011070676.
[172] Chertow GM, Levin NW, Beck GJ, et al. In-center hemodialysis six timesper week versus three times per week[J]. N Engl J Med, 2010, 363(24): 2287-2300. DOI: 10.1056/NEJMoa1001593.
[173] Culleton BF, Walsh M, Klarenbach SW, et al. Effect of frequent nocturnal hemodialysis vs conventional hemodialysis on left ventricular mass and quality of life: a randomized controlled trial[J]. JAMA, 2007, 298(11): 1291-1299. DOI: 10.1001/jama.298.11.1291.
[174] Mehrotra R, Himmelfarb J. Dialysis in 2012: could longer and more frequent haemodialysis improve outcomes?[J]. Nat Rev Nephrol, 2013,9(2): 74-75. DOI: 10.1038/nrneph.2012.287.
[175] Chertow GM, Levin NW, Beck GJ, et al. Long-term effects of frequent in-center hemodialysis[J]. J Am Soc Nephrol, 2016, 27(6): 1830-1836. DOI: 10.1681/ASN.2015040426.
[176] Wong B, Collister D, Muneer M, et al. In-center nocturnal hemodialysis versus conventional hemodialysis: a systematic review of the evidence[J]. Am J Kidney Dis, 2017, 70(2): 218-234. DOI: 10.1053/j.ajkd.2017.01.047.
[177] Rempher KJ. Continuous renal replacement therapy for management of over hydration in heart failure[J]. AACN Clin Issues, 2003, 14(4): 512-519. DOI: 10.1097/00044067-200311000-00012.
[178] Premuzic V, Basic-JukicN, Jelakovic B, et al. Continuous veno-venous hemofiltration improves survival of patients with congestive heart failure and cardiorenal syndrome compared to slow continuous ultrafiltration[J]. Ther Apher Dial, 2017, 21(3): 279-286. DOI: 10.1111/1744-9987.12516.
[179] Wohlfahrt P, Rokosny S, Melenovsky V, et al. Cardiac remodeling after reduction of high-flow arteriovenous fistulas in end-stage renal disease[J]. Hypertens Res, 2016, 39(9): 654-659. DOI: 10.1038/hr.2016.50.
[180] Chemla ES, Morsy M, Anderson L, et al. Inflow reduction by distalization of anastomosis treats efficiently high-inflow high-cardiac output vascular access for hemodialysis[J]. Semin Dial, 2007, 20(1): 68-72. DOI: 10.1111/j.1525-139X.2007.00244.x.
[181] Parmar CD, Chieng G, Abraham KA, et al. Revision using distalin flow for treatment of heart failure secondary to arteriovenous fistula for hemodialysis[J]. J Vasc Access, 2009, 10(1): 62-63. DOI: 10.1177/112972980901000112.
[182] Bourquelot P. Access flow reduction for cardiac failure[J]. J Vasc Access, 2016, 17 Suppl 1: S60-S63. DOI: 10.5301/jva.5000517.
[183] Rao NN, Stokes MB, Rajwani A, et al. Effects of arteriovenous fistula ligation on cardiac structure and function in kidney transplant recipients[J]. Circulation, 2019, 139(25): 2809-2818. DOI: 10.1161/CIRCULATIONAHA.118.038505.
[184] Sars B, van der Sande FM, Kooman JP. Intradialytic hypotension: mechanisms and outcome[J]. Blood Purif, 2020, 49(1-2): 158-167. DOI: 10.1159/000503776.
[185] Odudu A, Eldehni MT, McCann GP, et al. Randomized controlled trial of individualized dialysate cooling for cardiac protection in hemodialysis patients[J]. Clin J Am Soc Nephrol, 2015, 10(8): 1408-1417. DOI: 10.2215/CJN.00200115.
[186] Elshahawy Y, Sany D, Shawky S. Outcome of individualized dialysate sodium concentration for hemodialysis patients[J]. Saudi J Kidney Dis Transpl, 2013, 24(3): 507-513. DOI: 10.4103/1319-2442.111025.
[187] Chionh CY, Clementi A, Poh CB, et al. The use of peritoneal dialysis in heart failure: a systematic review[J]. Perit Dial Int,2020, 40(6): 527-539. DOI: 10.1177/0896860819895198.
[188] Teitelbaum I, Glickman J, Neu A, et al. KDOQI US Commentary on the 2020 ISPD Practice Recommendations for Prescribing High-Quality Goal-Directed Peritoneal Dialysis[J]. Am J Kidney Dis, 2021,77(2): 157-171. DOI: 10.1053/j.ajkd.2020.09.010.
[189] Rodríguez-Carmona A, Fontán MP. Sodium removal in patients undergoing CAPD and automated peritoneal dialysis[J]. Perit Dial Int, 2002, 22(6): 705-713.
[190] Kalantar-Zadeh K,Tortorici AR, Chen JL, et al. Dietary restrictions in dialysis patients: is there anything left to eat?[J]. Semin Dial, 2015, 28(2): 159-168. DOI: 10.1111/sdi.12348.
[191] 陈香美. 腹膜透析标准操作规程[M]. 北京: 人民军医出版社, 2010.
[192] Ok E. How to successfully achieve salt restriction indialysis patients? What are the outcomes?[J]. Blood Purif, 2010, 29(2): 102-104. DOI: 10.1159/000245633.
[193] Dombros N, Dratwa M, Feriani M, et al. European best practice guidelines for peritoneal dialysis. 7 Adequacy of peritoneal dialysis[J]. Nephrol Dial Transplant, 2005, 20 Suppl 9: ix24-ix27. DOI: 10.1093/ndt/gfi1121.
[194] Mullens W, Abrahams Z, Francis GS, et al. Prompt reduction in intra-abdominal pressure following large-volume mechanical fluid removal improves renal insufficiency in refractory decompensated heart failure[J]. J Card Fail, 2008, 14(6): 508-514. DOI: 10.1016/j.cardfail.2008.02.010.
[195] Davison SN, Jhangri GS, Jindal K, et al. Comparison of volume overload with cycler-assisted versus continuous ambulatory peritoneal dialysis[J]. Clin J Am Soc Nephrol, 2009, 4(6): 1044-1050. DOI: 10.2215/CJN.00020109.
[196] Cheng LT, Tang W, Wang T. Strong association between volume status and nutritional status in peritoneal dialysis patients[J]. Am J Kidney Dis, 2005, 45(5): 891-902. DOI: 10.1053/j.ajkd.2005.01.037.
[197] Akonur A, Guest S, Sloand JA, et al. Automated peritoneal dialysis prescriptions for enhancing sodium and fluid removal: a predictive analysis of optimized, patient-specific dwell times for the day period[J]. Perit Dial Int, 2013, 33(6): 646-654. DOI: 10.3747/pdi.2012.00261.
[198] Tanaka M, Ishibashi Y, Hamasaki Y, et al. Bioimpedance spectroscopy-based fluid status in combined dialysis compared with hemodialysis and peritoneal dialysis: a cross-sectional study[J]. Ther Apher Dial, 2020, 24(4): 373-379. DOI: 10.1111/1744-9987.13444.
[199] Tanaka M, Mise N, Nakajima H, et al. Effects of combination therapy with peritoneal dialysis and hemodialysis on left ventricular hypertrophy[J]. Perit Dial Int, 2011, 31(5): 598-600. DOI: 10.3747/pdi.2010.00273.
[200] Fukui H, Hara S, Hashimoto Y, et al. Review of combination of peritoneal dialysis and hemodialysis as a modality of treatment for end-stage renal disease[J]. Ther Apher Dial, 2004, 8(1): 56-61. DOI: 10.1111/j.1526-0968.2004.00107.x.
[201] Dombros N, Dratwa M, Feriani M, et al. European best practice guidelines for peritoneal dialysis. 9 PD and transplantation[J]. Nephrol Dial Transplant, 2005, 20 Suppl 9: ix34-ix35. DOI: 10.1093/ndt/gfi1123.
[202] Wilkie ME, Plant MJ, Edwards L, et al. Icodextrin 7.5% dialysate solution (glucose polymer) in patients with ultrafiltration failure: extension of CAPD technique survival[J]. Perit Dial Int, 1997, 17(1): 84-87.
[203] Finkelstein F, Healy H, Abu-Alfa A, et al. Superiority of icodextrin compared with 4.25% dextrose for peritoneal ultrafiltration[J]. J Am Soc Nephrol, 2005, 16(2): 546-554. DOI: 10.1681/ASN.2004090793.
[204] Sánchez JE, Ortega T, Rodríguez C, et al. Efficacy of peritoneal ultrafiltration in the treatment of refractory congestive heart failure[J]. Nephrol Dial Transplant, 2010, 25(2): 605-610. DOI: 10.1093/ndt/gfp484.
[205] Wojtaszek E, Grzejszczak A, Niemczyk S, et al. Peritoneal ultrafiltration in the long-term treatment of chronic heart failure refractory to pharmacological therapy[J]. Front Physiol, 2019, 10: 310. DOI: 10.3389/fphys.2019.00310.
[206] Inampudi C, Alvarez P, Asleh R, et al. Therapeutic approach to patients with heart failure with reduced ejection fraction and end-stage renal disease[J]. Curr Cardiol Rev, 2018, 14(1): 60-66. DOI: 10.2174/1573403X14666180123164916.
[207] Medcalf JF, Harris KP, Walls J. Role of diuretics in thepreservation of residual renal function in patients on continuous ambulatoryperitoneal dialysis[J]. Kidney Int, 2001, 59(3): 1128-1133. DOI: 10.1046/j.1523-1755.2001.0590031128.x.
[208] Novak JE, Ellison DH. Diuretics in states of volume overload: core curriculum 2022[J]. Am J Kidney Dis, 2022 : S0272-6386(21)01019-2. DOI: 10.1053/j.ajkd.2021.09.029.
[209] Kim YL. Impact of high-dose diuretic combination therapy on volume status in peritoneal dialysis patients[J]. Kidney Res Clin Pract, 2019, 38(1): 3-5. DOI: 10.23876/j.krcp.19.017.
[210] Zoccali C, Mallamaci F, Parlongo S, et al. Plasma norepinephrine predicts survival and incident cardiovascular events in patients with end-stage renal disease[J]. Circulation, 2002, 105(11): 1354-1359. DOI: 10.1161/hc1102.105261.
[211] Cice G, Ferrara L, D‘Andrea A, et al. Carvedilol increases two-year survivalin dialysis patients with dilated cardiomyopathy: a prospective, placebo-controlled trial[J]. J Am Coll Cardiol, 2003, 41(9): 1438-1444. DOI: 10.1016/s0735-1097(03)00241-9.
[212] Tang CH, Wang CC, Chen TH, et al. Prognostic benefits of carvedilol, bisoprolol, and metoprolol controlled release/extended release in hemodialysis patients with heart failure: a 10-year cohort[J]. J Am Heart Assoc, 2016, 5(1): e002584. DOI: 10.1161/JAHA.115.002584.
[213] Weir MA, Dixon SN, Fleet JL, et al. β-Blocker dialyzability and mortality in older patients receiving hemodialysis[J]. J Am Soc Nephrol, 2015, 26(4): 987-996. DOI: 10.1681/ASN.2014040324.
[214] Wu PH, Lin YT, Liu JS, et al. Comparative effectiveness of bisoprolol and carvedilol among patients receiving maintenance hemodialysis[J]. Clin Kidney J, 2021, 14(3): 983-990. DOI: 10.1093/ckj/sfaa248.
[215] Boeuf-GibotS, Pereira B, Imbert J, et al. Benefits and adverse effects of ACE inhibitors in patients with heart failure with reduced ejection fraction: a systematic review and meta-analysis[J]. Eur J Clin Pharmacol, 2021, 77(3): 321-329. DOI: 10.1007/s00228-020-03018-4.
[216] CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study(CONSENSUS)[J]. N Engl J Med, 1987, 316(23): 1429-1435. DOI: 10.1056/NEJM198706043162301.
[217] Zannad F, Kessler M, Lehert P, et al. Prevention of cardiovascular events in end-stage renal disease: results of a randomized trial of fosinopril and implications for future studies[J]. Kidney Int, 2006, 70(7): 1318-1324. DOI: 10.1038/sj.ki.5001657.
[218] Efrati S, Zaidenstein R, Dishy V, et al. ACE inhibitors and survival of hemodialysis patients[J]. Am J Kidney Dis, 2002, 40(5): 1023-1029. DOI: 10.1053/ajkd.2002.36340.
[219] McCullough PA, Sandberg KR, Yee J, et al. Mortality benefit of angiotensin-converting enzyme inhibitors after cardiac events in patients with end-stage renal disease[J]. J Renin Angiotensin Aldosterone Syst, 2002, 3(3): 188-191. DOI: 10.3317/jraas. 2002.040.
[220] Tokmakova MP, Skali H, Kenchaiah S, et al. Chronic kidney disease, cardiovascular risk, and response to angiotensin-converting enzyme inhibition after myocardial infarction: the Survival And Ventricular Enlargement (SAVE) study[J]. Circulation, 2004, 110(24): 3667-3673. DOI: 10.1161/01.CIR.0000149806.01354.BF.
[221] Bowling CB, Sanders PW, Allman RM, et al. Effects of enalaprilin systolic heart failure patients with and without chronic kidney disease: insights from the SOLVD Treatment trial[J]. Int J Cardiol, 2013, 167(1): 151-156. DOI: 10.1016/j.ijcard.2011.12.056.
[222] Li PK, Chow KM, Wong TY, et al. Effects of an angiotensin-converting enzyme inhibitor on residual renal function in patients receiving peritoneal dialysis. A randomized, controlled study[J]. Ann Intern Med, 2003, 139(2): 105-112. DOI: 10.7326/0003-4819-139-2-200307150-00010.
[223] Duman S, Sen S, Duman C, et al. Effect of valsartan versus lisinopril on peritoneal sclerosis in rats[J]. Int J Artif Organs, 2005, 28(2): 156-163. DOI: 10.1177/039139880502800212.
[224] Knoll GA, Sahgal A, Nair RC, et al. Renin-angiotensin system blockade and the risk of hyperkalemia in chronic hemodialysis patients[J]. Am J Med, 2002, 112(2): 110-114. DOI: 10.1016/s0002-9343(01)01068-3.
[225] Cice G, Di Benedetto A, D‘Isa S, et al. Effects of telmisartan added to angiotensin-converting enzyme inhibitors on mortality and morbidity in hemodialysis patients with chronic heart failure a double-blind, placebo-controlled trial[J]. J Am CollCardiol, 2010, 56(21): 1701-1708. DOI: 10.1016/j.jacc.2010.03.105.
[226] Suzuki H, Kanno Y, Sugahara S, et al. Effects of anangiotensinII receptor blocker, valsartan, on residual renal function in patientson CAPD[J]. Am J Kidney Dis, 2004, 43(6): 1056-1064. DOI: 10.1053/j.ajkd.2004.01.019.
[227] Bavishi C, Messerli FH, Kadosh B, et al. Role of neprilysin inhibitor combinations in hypertension: insights from hypertension and heart failure trials[J]. Eur Heart J, 2015, 36(30): 1967-1973. DOI:10.1093/eurheartj/ehv142.
[228] Damman K, Gori M, Claggett B, et al. Renal effects and associated outcomes during angiotensin-neprilysin inhibition in heart failure[J]. JACC Heart Fail, 2018, 6(6): 489-498. DOI: 10.1016/j.jchf.2018.02.004.
[229] Chang HY, Feng AN, Fong MC, et al. Sacubitril/valsartan in heart failure with reduced ejection fraction patients: real world experience on advanced chronic kidney disease, hypotension, and dose escalation[J]. J Cardiol, 2019, 74(4): 372-380. DOI: 10.1016/j.jjcc.2019.03.010.
[230] Lee S, Oh J, Kim H, et al. Sacubitril/valsartan in patients with heart failure with reduced ejection fraction with end-stage of renal disease[J]. ESC Heart Fail, 2020, 7(3): 1125-1129. DOI: 10.1002/ehf2.12659.
[231] House AA, Wanner C, Sarnak MJ, et al. Heart failure in chronic kidney disease: conclusions from a Kidney Disease: Improving Global Outcomes(KDIGO) Controversies Conference[J]. Kidney Int, 2019, 95(6): 1304-1317. DOI: 10.1016/j.kint.2019.02.022.
[232] Feng Z, Wang X, Zhang L, et al. Pharmacokinetics and pharmacodynamics of sacubitril/valsartan in maintenance hemodialysis patients with heart failure[J]. Blood Purif, 2022, 51(3): 270-279. DOI: 10.1159/000519643.
[233] Feng Y, Yin Y, Deng R, et al. Renal safety and efficacy of angiotensin receptor-neprilysin inhibitor: a meta-analysis of randomized controlled trials[J]. J Clin Pharm Ther, 2020, 45(6): 1235-1243. DOI: 10.1111/jcpt.13243.
[234] Packer M, Califf RM, Konstam MA, et al. Comparison of omapatrilatand enalapril in patients with chronic heart failure: the Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE)[J]. Circulation, 2002, 106(8): 920-926. DOI: 10.1161/01.cir.0000029801.86489.50.
[235] Vardeny O, Miller R, Solomon SD. Combined neprilysin and renin-angiotensin system inhibition for the treatment of heart failure[J]. JACC Heart Fail, 2014, 2(6): 663-670. DOI: 10.1016/j.jchf.2014.09.001.
[236] Kostis JB, Packer M, Black HR, et al. Omapatrilat and enalaprilin patients with hypertension: the Omapatrilat Cardiovascular Treatment vs. Enalapril (OCTAVE) trial[J]. AmJ Hypertens, 2004, 17(2): 103-111. DOI: 10.1016/j.amjhyper.2003.09.014.
[237] Yancy CW, Jessup M, Bozkurt B, et al. 2017ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America[J]. J Am Coll Cardiol, 2017, 70(6): 776-803. DOI: 10.1016/j.jacc.2017.04.025.
[238] Greene EL, Kren S, Hostetter TH. Role of aldosterone in the remnant kidney model in the rat[J]. J Clin Invest, 1996, 98(4): 1063-1068. DOI: 10.1172/JCI118867.
[239] Rocha R, Chander PN, Zuckerman A, et al. Role of aldosterone in renal vascular injury in stroke-prone hypertensive rats[J]. Hypertension, 1999, 33(1 Pt 2): 232-237. DOI: 10.1161/01.hyp.33.1.232.
[240] Bomback AS, Rekhtman Y, Klemmer PJ, et al. Aldosterone breakthrough during aliskiren, valsartan, and combination (aliskiren + valsartan) therapy[J]. J Am Soc Hypertens, 2012, 6(5): 338-345. DOI: 10.1016/j.jash.2012.07.003.
[241] Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators[J]. N Engl J Med, 1999, 341(10): 709-717. DOI: 10.1056/NEJM199909023411001.
[242] Chua D, Lo A, Lo C. Spironolactone use in heart failure patients with end-stage renal disease on hemodialysis: is it safe?[J]. Clin Cardiol, 2010, 33(10): 604-608. DOI: 10.1002/clc.20838.
[243] Charytan DM, Himmelfarb J, Ikizler TA, et al. Safety and cardiovascular efficacy of spironolactone in dialysis-dependent ESRD (SPin-D): a randomized, placebo-controlled, multiple dosage trial[J]. Kidney Int, 2019, 95(4): 973-982. DOI: 10.1016/j.kint.2018.08.034.
[244] Hammer F, Malzahn U, Donhauser J, et al. A randomized controlled trial of the effect of spironolactone on left ventricular mass in hemodialysis patients[J]. Kidney Int, 2019, 95(4): 983-991. DOI: 10.1016/j.kint.2018.11.025.
[245] Li Y, Xie N, Liang M. Aldosterone antagonists reduce the risk of cardiovascular mortality in dialysis patients: a meta-analysis[J]. Evid Based Complement Alternat Med, 2019, 2019: 1925243. DOI: 10.1155/2019/1925243.
[246] Agarwal A, Cheung AK. Mineralocorticoid receptor antagonists in ESKD[J]. Clin J Am Soc Nephrol, 2020, 15(7): 1047-1049. DOI: 10.2215/CJN.13221019.
[247] Weiner ID, Wingo CS. Hypokalemia --consequences, causes, and correction[J]. J Am Soc Nephrol, 1997, 8(7): 1179-1188. DOI: 10.1681/ASN.V871179.
[248] Fül?p T, Zsom L, RodríguezB, et al. Clinical utility of potassium - sparing diuretics to maintain normal serum potassium in peritoneal dialysis patients[J]. Perit Dial Int, 2017,37(1): 63-69. DOI: 10.3747/pdi.2016.00022.
[249] Han L, Yang XD. Role of spironolactone chalcone in the prevention of peritoneal fibrosis in patients with peritoneal dialysis[J]. Trop J Pharm Res, 2015, 14(10): 1893-1897. https://www.ajol.info//index.php/tjpr/article/view/125296.
[250] Agarwal R, Kolkhof P, Bakris G, et al. Steroidal and non-steroidal mineralocorticoid receptor antagonists in cardio renal medicine[J]. Eur Heart J, 2021, 42(2): 152-161. DOI: 10.1093/eurheartj/ehaa736.
[251] Pitt B, Kober L, Ponikowski P, et al. Safety and tolerability of the novel non-steroidal mineralocorticoid receptor antagonist BAY 94-8862 in patients with chronic heart failure and mild or moderate chronic kidney disease: a randomized, double-blind trial[J]. Eur Heart J, 2013, 34(31): 2453-2463. DOI: 10.1093/eurheartj/eht187.
[252] Chan KE, Lazarus JM, Hakim RM. Digoxin associates with mortality in ESRD[J]. J Am Soc Nephrol, 2010, 21(9): 1550-1559. DOI: 10.1681/ASN.2009101047.
[253] Volterrani M, Cice G, Caminiti G, et al. Effect of Carvedilol, Ivabradine or their combination on exercise capacity in patients with Heart Failure (the CARVIVA HF trial) [J]. Int J Cardiol, 2011, 151(2): 218-224. DOI: 10.1016/j.ijcard.2011.06.098.
[254] Di Lullo L, Bellasi A, Russo D, et al. Ivabradine, heart failure and chronic kidney disease[J]. Nephrology, 2015, 1(1): e39-e43. DOI: 10.5301/poc.5000190.
[255] Taylor AL, Ziesche S, Yancy C, et al. Combination of isosorbide dinitrate and hydralazine in blacks with heart failure[J]. N Engl J Med, 2004, 351(20): 2049-2057. DOI: 10.1056/NEJMoa 042934.
[256] Armstrong PW, Pieske B, Anstrom KJ, et al. Vericiguat in patients with heart failure and reduced ejection fraction[J]. N Engl J Med, 2020, 382(20): 1883-1893. DOI: 10.1056/NEJMoa1915928.
[257] Voors AA, Mulder H, Reyes E, et al. Renal function and the effects of vericiguat in patients with worsening heart failure with reduced ejection fraction: insights from the VICTORIA (Vericiguat Global Study inSubjects with HFrEF) trial[J]. Eur J Heart Fail, 2021, 23(8): 1313-1321. DOI: 10.1002/ejhf.2221.
[258] Mc Causland FR, Lefkowitz MP, Claggett B, et al. Angiotensin-neprilysin inhibition and renal outcomes in heart failure with preserved ejection fraction[J]. Circulation, 2020, 142(13): 1236-1245. DOI: 10.1161/CIRCULATIONAHA.120.047643.
[259] Fu S, Xu Z, Lin B, et al. Effects of sacubitril-valsartan in heart failure with preserved ejection fraction in patients undergoing peritoneal dialysis[J]. Front Med (Lausanne), 2021, 8: 657067. DOI: 10.3389/fmed.2021.657067.
[260] Khan MS, Khan MS, Moustafa A, et al. Efficacy and safety of mineralocorticoid receptor antagonists in patients with heart failure and chronic kidney disease[J]. Am J Cardiol, 2020, 125(4): 643-650. DOI: 10.1016/j.amjcard.2019.11.014.
[261] Hsu S, Bansal N. Updates in the management of heart failure for the chronic kidney disease patient[J]. Curr Opin Nephrol Hypertens, 2019, 28(3): 262-266. DOI: 10.1097/MNH.0000000000000497.
[262] Bansal N, Hailpern SM, Katz R, et al. Outcomes associated with left ventricular assist devices among recipients with and without end-stage renal disease[J]. JAMA Intern Med, 2018, 178(2): 204-209. DOI: 10.1001/jamainternmed.2017.4831.
[263] Bansal N, Szpiro A, Reynolds K, et al. Long-term outcomes associated with implantable cardioverter defibrillator in adults with chronic kidney disease[J]. JAMA Intern Med, 2018, 178(3): 390-398. DOI: 10.1001/jamainternmed.2017.8462.
[264] Boyce ML, Robergs RA, Avasthi PS, et al. Exercise training by individuals with predialysis renal failure: cardiorespiratory endurance, hypertension, and renal function[J]. Am J Kidney Dis, 1997, 30(2): 180-192. DOI: 10.1016/s0272-6386(97)90051-2.
[265] Chen IR, Wang SM, Liang CC, et al. Association of walking with survival and RRT among patients with CKD stages 3-5[J]. Clin J Am Soc Nephrol, 2014, 9(7): 1183-1189. DOI: 10.2215/CJN.09810913.
[266] Stack AG, Molony DA, Rives T, et al. Association of physical activity with mortality in the US dialysis population[J]. Am J Kidney Dis, 2005, 45(4): 690-701. DOI: 10.1053/j.ajkd.2004.12.013.
[267] 鲁新红, 唐雯, 苏春燕, 等. 老年持续非卧床腹膜透析患者饮食和营养状况调查分析[J]. 护理管理杂志, 2014, 14(8): 566-568. DOI: 10.3969/j.issn.1671-315X.2014.08.014.
[268] Ambrosy AP, Mulder H, Coles A, et al. Renal function and exercise training in ambulatory heart failure patients with a reduced ejection fraction[J]. Am J Cardiol, 2018, 122(6): 999-1007. DOI: 10.1016/j.amjcard.2018.06.011.
[269] Scapini KB, Bohlke M, Moraes OA, et al. Combined training is the most effective training modality to improve aerobic capacity and blood pressure control in people requiring haemodialysis for end-stage renal disease: systematic review and network meta-analysis[J]. J Physiother, 2019, 65(1): 4-15. DOI: 10.1016/j.jphys.2018.11.008.
[270] Clarkson MJ, Bennett PN, Fraser SF, et al. Exercise interventions for improving objective physical function in patients with end-stage kidney disease on dialysis: a systematic review and meta-analysis[J]. Am J Physiol Renal Physiol, 2019, 316(5): F856-F872. DOI: 10.1152/ajprenal.00317.2018.
转自中华肾脏病杂志公众号,如有侵权请联系删除。
(收稿日期:2021?08?12)
(本文编辑:杨克魁)
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论