精选内容
-
移植后患者外出注意事项

 范志平医生的科普号
范志平医生的科普号 2023年12月16日
2023年12月16日 167
167
 0
0
 7
7
-
造血干细胞移植后肝窦隙阻塞综合征诊断与治疗中国专家共识(2022年版)
肝窦隙阻塞综合征(sinusoidalobstructionsyndrome,SOS)也称肝静脉闭塞症(veno-occlusivedisease,VOD),多发生于摄入某些毒性生物碱、高剂量放/化疗和器官移植的患者,是一种可危及生命的严重疾病。造血干细胞移植(HSCT)患者是SOS最主要的发病人群,SOS也是移植早期的重要合并症和死亡原因之一。本共识在参考该领域国外指南/共识的基础上,纳入国内的主要研究成果和临床经验,结合现时国情,为各移植单位SOS规范化诊疗提供指导性意见。一、定义和流行病学HSCT后SOS是指HSCT后早期发生的、预处理相关肝毒性导致的一类主要表现为黄疸、液体潴留、肝肿大等特征的临床综合征,重症患者病死率可高达80%[1,2,3]。因患者特征、预处理方案、移植中心经验、诊断标准等差异,SOS发生率在不同研究中的差异较大。一项荟萃分析显示中位发生率为13.7%(0~62.3%)[4]。综合来看,自体HSCT(auto-HSCT)后发生率为3.1%~8.7%,异基因HSCT(allo-HSCT)为8.9%~14.0%[4,5,6,7,8]。儿童HSCT患者发生率略高于成人[9,10,11,12]。国内广西医科大学附属第一院报道allo-HSCT后SOS发生率为7.4%[13]。近年来发生率及严重程度总体有所下降,但某些药物(如CD33、CD22等单抗)的应用、增加强度预处理、二次移植等在一定程度上会增加患者发病风险。二、发病机制SOS的发病机制尚未明确,目前认为预处理方案相关肝毒性为首要病因。白消安(BU)、环磷酰胺(CTX)、全身放疗(TBI)等对窦隙内皮细胞(SEC)和肝细胞的毒性损伤是SOS发生的直接原因,肝小叶中心区域(肝腺泡3区)因缺乏谷胱甘肽(GSH)而更易发生损伤[14,15,16]。除预处理外,组织损伤产生的细胞因子、药物[钙调神经磷酸酶抑制剂(CNI)、造血生长因子、抗体药物等]、异源反应性T细胞、某些GSHS-转移酶相关基因突变、内源微生物代谢物的迁移及造血植入等也可导致或加重SEC损伤[17,18,19,20,21,22,23,24]。SEC损伤导致内皮细胞屏障破坏,窦壁完整性丧失,红细胞渗至狄氏(Disse)腔,引起内皮细胞分离,造成肝窦隙阻塞;此外,凝血-纤溶系统失衡可致微血栓形成,加重小叶中心静脉阻塞,最终形成窦后性门静脉高压。发展至重症者小叶中心坏死、纤维化,肝功能衰竭。鉴于内皮损伤在发病机制中的中心地位,也有学者将SOS纳入HSCT相关内皮损伤综合征范畴[25,26]。三、危险因素SOS发病危险因素一般分为患者相关和移植相关两类。前者主要包括:年龄、体能状况、移植前肝病史/肝功能异常、疾病进展状态、地中海贫血、铁过载、腹部放疗史、应用吉妥珠单抗(Gemtuzumabozogamicin)或奥加伊妥珠单抗(Inotuzumabozogamicin)[27,28,29]。后者主要包括:allo-HSCT(相比auto-HSCT)、HLA不合/单倍型移植、二次移植、移植物非去T细胞、含BU或TBI预处理、氟达拉滨、CNI联合西罗莫司预防GVHD等。识别危险因素或构建前瞻性风险评估模型有助于SOS的早期预测和预防[30]。四、诊断、分级及鉴别诊断典型SOS多发生于HSCT后21d内,迟发型可发生于21d后。可隐匿发病,也可急骤进展。主要临床表现包括右上腹压痛、黄疸、痛性肝肿大、腹水、体重增加、水肿等。实验室检查可见高胆红素血症、转氨酶升高、难以解释的血小板减少等。影像学(推荐多普勒超声)检查可发现肝肿大、腹水、胆囊壁水肿、肝/门静脉血流减慢或反向血流、门静脉增宽等[31,32]。轻症患者呈自限性,重症者可出现肾、肺、心脏等多器官功能衰竭(MOF),预后凶险。肝组织活检病理是诊断金标准,但在移植早期实施出血风险大,不常规推荐。有经验的单位可选择经颈静脉肝活检或测量肝静脉压力梯度(HVPG)辅助诊断。近年以瞬时弹性成像技术(TE)进行肝硬度检测(LSM),预测和诊断的敏感性及特异性较高[33,34,35]。目前尚无具有预测或诊断意义的生物学标志物。纤溶酶原激活物抑制物-1(PAI-1)等血凝标志物有一定的预测价值,内皮细胞损伤及炎症标志物尚在探索中[36,37,38,39,40],不推荐常规检测。SOS临床诊断多依据修订的西雅图(Seattle)标准[41]或巴尔的摩(Baltimore)标准[42]。2016年欧洲骨髓移植学会(EBMT)提出的SOS标准[3]具有较好的实用性,本共识推荐使用该标准,也可与前述2个标准并行使用。各诊断标准见表1。儿童SOS的EBMT诊断标准[10]:无发生时间限定,至少满足2条下述表现:①难以解释的消耗性血小板减少和无效输注;②即使应用利尿剂,仍有难以解释的连续3d体重增加或体重增加>5%基线值;③高于基线值的肝脏肿大(建议影像学确认);④高于基线值的腹水(建议影像学确认);⑤连续3d胆红素高于基线值,或72h内胆红素≥2mg/dl。值得注意的是,16%~20%的儿童SOS为迟发型,近30%无黄疸表现[43,44]。本共识推荐采用美国血液学会SOS分级标准[45](表2)及EBMT分级标准[3](表3)进行严重程度分级。SOS需要与以下疾病鉴别:肝脏急性GVHD、病毒性肝炎、药物性肝损伤、毛细血管渗漏综合征(CLS)、移植相关血栓性微血管病(TA-TMA)等,鉴别要点见表4。五、预防1.一般原则:避免SOS危险因素,包括祛铁治疗、避免肝炎活动期进行HSCT、预处理方案调整(减低强度、药代动力学指导BU用药、分次TBI等)、避免合用肝毒性药物、警惕某些药物应用(CD33/CD22单抗等)增加SOS风险;液体平衡管理(避免超负荷,同时维持有效血容、避免肾灌注不足);HSCT后早期应监测体重、腹围等变化。2.预防药物:①熊去氧胆酸(UDCA):随机对照临床试验(RCT)及荟萃分析显示UDCA可降低HSCT后SOS发生率[46,47,48,49]。部分研究未能观察到上述结果,但发现Ⅲ/Ⅳ度肝脏急性GVHD发生率明显下降,1年总生存(OS)率更优[50]。目前,UDCA在国内外已得到普遍应用[25,51,52]。推荐用法:UDCA12~15mg·kg-1·d-1,移植前开始服用,移植后100d停药。②普通肝素或低分子量肝素:临床应用和试验研究较多,RCT及荟萃分析(包括儿童及成人)结论不一[7,53,54,55,56,57],国内应用较多。前列腺素E1(PGE1):相关RCT研究缺少一致性结论,国内应用较多。③中成药:复方丹参、复方川穹嗪等,国内部分移植中心有应用经验。④去纤苷(DF):提取自猪肠黏膜的一种单链多聚脱氧核苷酸复合物,机制尚未完全阐明。初步发现具有保护内皮、恢复血栓-纤溶平衡、抗凝及调节血小板活性等作用,不显著增加出血风险。DF是目前国外唯一获批的SOS治疗药物,尚未批准用于预防,但多个预防的RCT研究结果令人鼓舞[9,58,59]。荟萃分析显示,DF预防组SOS发生率显著低于对照组(4.7%对13.7%)[60]。除降低SOS发生率外,DF还可降低SOS相关死亡率及急性GVHD发生率[9,61,62]。推荐用法:DF6.25mg/kg,每6h1次,每次维持2h静脉给药,自预处理开始用药,移植后30d停药。本共识建议,SOS高危患者,如有条件可选用DF预防,常规预防可选用UDCA、普通或低分子肝素、前列腺素E1及中成药等,也可联合用药,建议各中心根据各自经验选用[63]。鼓励积极开展相关的临床试验研究。六、治疗进行严重程度分级有利于分层治疗。约70%的轻症患者经暂停CNI等可疑药物并给予利尿、液体平衡管理等支持治疗即可恢复。暂停CNI时应审慎评估GVHD风险,必要时予糖皮质激素、霉酚酸酯、CD25单抗等药物替代。重度及极重度患者应立即启动特异性治疗。轻、中度患者接受支持治疗,严密观察并根据病情变化及时调整治疗方案,以防病情恶化。1.支持治疗:每日监测患者体重、腹围、尿量、出入量等,评估病情及治疗反应。去除可疑诱因,严格管理水钠摄入,利尿,输注白蛋白、血浆或成分血,维持循环血量和肾灌注。胸/腹腔大量积液时,可适度抽液以减轻压迫。低氧状态时给予氧疗或机械通气。必要时镇痛治疗,合并肾功能衰竭时进行血液透析或滤过治疗。重症患者建议转重症监护病房(ICU)或进行多学科会诊(MDT)。2.特异性治疗:常用药物包括DF、重组人组织型纤溶酶原激活物(rh-tPA)、糖皮质激素等。(1)DF:DF是欧美国家唯一批准的重度SOS治疗药物,疗效和安全性已被多个较高质量的临床研究证实。完全缓解(CR)率为25.5%~55.0%,100d生存率为38.2%~58.9%(不伴MOF者达71.0%),儿童疗效优于成人,主要不良事件为出血(肺、消化道)[64,65,66,67]。一项纳入140例SOS患者的上市后Ⅳ期研究结果显示,DF治疗后100d生存率为58%,其中重度病例生存率为79%,极重度病例为34%[68]。推荐用法:6.25mg·kg-1·h-1(2h静脉滴注),依据治疗反应用药2~3周。有出血风险患者,可根据经验酌情减量。获得CR或发生严重出血时,可停药观察。(2)rh-tPA:属丝氨酸蛋白酶,与纤维蛋白结合后,诱导纤溶酶原转化为纤溶酶,降解纤维蛋白,发挥溶栓活性。较早期的国外指南将其列为不能获得DF时的可选择药物之一,后基于较高的严重出血风险(近30%)而不再推荐[25]。近年国内陈峰等以低剂量rh-tPA(10mg/d)为主方案治疗16例HSCT后重度/极重度SOS,CR率及100d生存率均达到75%,无严重出血相关死亡[69,70]。(3)糖皮质激素:早期应用有一定疗效。甲泼尼龙(MP)0.5mg/kg,每日2次,反应率为63%,100d生存率为58%[71]。Myers等[72]应用MP治疗儿童SOS(500mg/m2,每日2次),反应率为66.7%。应用时应警惕增加感染风险。(4)其他:对治疗无反应、进展的SOS患者,如有条件,可尝试经颈静脉肝内门体静脉分流术(TIPS)、肝移植等挽救治疗。共识建议采取分层治疗策略,需特异性治疗的患者在支持治疗基础上可加用DF。目前DF尚未在国内上市,各中心可根据各自经验选择低剂量rh-tPA、糖皮质激素等治疗,鼓励开展相关的临床试验研究。引自:中华血液学杂志,2022,43(3) :177-183.DOI:10.3760/cma.j.issn.0253-2727.2022.03.001
 贾晋松医生的科普号
贾晋松医生的科普号 2023年11月12日
2023年11月12日 303
303
 0
0
 0
0
-
造血干细胞移植后闭塞性细支气管炎综合征诊断与治疗中国专家共识(2022年版)
闭塞性细支气管炎综合征(bronchiolitisobliteranssyndrome,BOS)是造血干细胞移植(HSCT)后晚期死亡的主要原因之一,严重限制患者的日常活动能力,导致生活质量显著降低[1,2]。BOS通常起病隐匿,早期无症状,但出现明显症状时肺功能已严重受损,最终可发生呼吸功能衰竭甚至死亡。由于BOS早期诊断困难,且缺乏规范化诊治的共识和标准的临床路径,制定本共识对推动HSCT技术体系的优化具有重要的临床意义[3]。为进一步规范及促进BOS的早期诊断和治疗,中国医师协会血液科医师分会和中华医学会血液学分会组织国内相关专家制定本共识。一、BOS定义和流行病学特征BOS是一种以HSCT后新发的持续性气流受限为特征的临床综合征。其病理特征为闭塞性细支气管炎(bronchiolitisobliterans,BO),是指细支气管损伤后的上皮炎症反应,随后的修复导致气道壁、气腔或两者兼有的肉芽组织过度增生,修复过程可以引起小气道的狭窄、扭曲(缩窄性细支气管炎)或完全闭塞(BO)。BOS可仅通过肺功能改变和影像学特征建立临床诊断,无需BO的病理学诊断,在临床工作中应用更为广泛。引起BOS的病因主要是同种异体免疫反应,也可能是由于物理化学损伤(如空气污染、毒气、吸入异物等)、感染,还有部分患者为特发性[4]。BOS可以发生于HSCT后,尤其是异基因HSCT(allo-HSCT)后。以下BOS特指HSCT后的BOS。(一)发生率及危险因素allo-HSCT后BOS的发生率为3%~6.5%[5,6,7,8,9],自体HSCT后偶发[10]。BOS常发生于慢性移植物抗宿主病(cGVHD)患者,合并cGVHD时,发生率为7%~10%[9,11]。BOS发生的最主要危险因素是进展型cGVHD,也可能与新发或静止型cGVHD、高龄、移植前气流受限、呼吸道病毒(如流感、副流感、呼吸道合胞病毒等)感染相关[12]。(二)临床表现及预后BOS的临床表现包括慢性干咳、劳力性呼吸困难、运动耐量下降、喘息。临床症状通常在中重度患者中出现,其中20%~30%表现为明显的气流下降。听诊呼吸音正常,或可伴有哮鸣音。40%的患者伴有低氧血症。BOS患者20%可合并胸腔漏气综合征,表现为气胸、纵隔气肿及皮下气肿[6]。另外,BOS患者易合并肺感染,若临床上发现HSCT后患者反复发生肺感染,应考虑鉴别BOS[13]。未经积极治疗BOS患者的5年生存率仅为10%~13%,随着诊疗技术的进步,其5年生存率可达40%~60%[11,14,15,16,17]。目前认为与不良预后相关的因素包括:移植后早期(6~12个月)确诊BOS;确诊时第1秒用力呼气量(FEV1)低于30%预测值;确诊3个月内肺功能迅速恶化;同时合并aGVHD和其他部位cGVHD等[5,18,19]。二、BOS的辅助检查1.肺功能:肺功能检测是重要的辅助检查手段。BOS肺功能表现为阻塞性通气功能障碍,主要包括FEV1下降(实测值低于预测值的80%)、FEV1与用力肺活量(FVC)的比值(FEV1/FVC%)显著下降(低于70%)。FVC可在正常范围或轻度下降,肺总量(TLC)正常或增加,残气量(RV)升高(>预测值120%),残气量与肺总量比值(RV/TLC)增加(>40%)。BOS的气道阻塞病变为不可逆性,支气管舒张试验为阴性。建议:allo-HSCT后2年内,有条件的移植中心每3个月进行1次常规肺功能检查监测BOS,其后若有新出现的气流受限或其他部位新发的cGVHD表现,也应及时完善肺功能检查。2.高分辨率CT:高分辨率CT可发现大部分BOS患者的异常表现,但早期BOS患者也可基本正常[20,21,22,23,24]。BOS影像异常多位于双下肺和胸膜下。直接CT征象包括:外周细支气管壁增厚、小气道扩张和小叶中心性支气管结节影(细支气管扩张伴分泌物滞留);间接CT征象包括:"空气潴留征(肺实质异常低密度衰减区,且肺体积不缩小)"、"马赛克衰减征(不同区域的肺灌注差异导致的衰减差异)"、中央型气道扩张和过度通气等。建议:高分辨率CT辅助诊断BOS应包括呼气相及吸气相扫描;主要影像表现为外周细支气管壁增厚、小气道扩张、"空气潴留征"和"马赛克衰减征"。3.肺组织活检:病理学检查是诊断BO的金标准,可表现为淋巴细胞性细支气管炎或缩窄性细支气管炎[25]。淋巴细胞性细支气管炎主要表现为大量淋巴细胞浸润细支气管管壁。缩窄性细支气管炎的组织学特点为细支气管黏膜下或细支气管旁纤维化,细支气管管腔向心性狭窄或完全闭塞。淋巴细胞性细支气管炎患者的肺功能受损和预后可能好于缩窄性细支气管炎患者[25]。必需注意,肺活检可能导致气胸、纵隔气肿、持续性气漏综合征甚至死亡等严重并发症,临床上应用应格外谨慎[26]。建议:在有经验和有条件的移植中心,若BOS临床诊断难以明确且患者充分知情同意,慎重作出肺穿刺活检的临床决定,避免有创操作加重病情。三、BOS的诊断及评估(一)诊断标准BOS的诊断主要基于临床、影像学及肺功能检查。本共识推荐采用以下诊断标准(表1)[1,27,28,29]。(二)BOS的分度可以根据FEV1结果将BOS分为轻度(60%~75%)、中度(40%~59%)和重度(≤39%)[28]。(三)鉴别诊断在BOS诊断中,排除其他病因非常重要,包括感染、隐源性机化性肺炎(COP)、晚期放疗毒性、哮喘、慢性阻塞性肺疾病等(图1)。1.感染:诊断BOS必须排除感染引起的细支气管炎[30]。需注意,BOS也常同时合并感染,且感染可诱发BOS加重[13]。推荐:对疑似BOS患者进行全面病原检测,包括影像学、血培养、痰培养、咽拭子培养、病毒载量测定、呼吸道病原体抗体检测、G试验、GM试验、支气管肺泡灌洗等[31,32,33]。若患者处于肺部感染状态,首先积极控制感染,再进一步明确BOS诊断。若感染反复难愈,BOS诊断困难,可在有条件的中心谨慎行活检以明确诊断。2.隐源性机化性肺炎(COP):通常发生在移植后1~13个月,中位发生时间为3~4个月,症状包括发热、气短、干咳,需与HSCT后BOS鉴别。COP的肺功能通常表现为限制性通气功能障碍,主要表现为肺一氧化碳弥散(DLCO)显著下降,而FEV1/FVC比值正常;高分辨率CT常可观察到弥漫分布的实变影、支气管充气征及磨玻璃结节[34];组织病理活检表现为远端气道及肺泡充填肉芽组织及纤维化,可伴有间质和肺泡炎症[24]。3.其他:迟发性肺毒性综合征在接受高剂量化疗及自体HSCT的患者中多见,可发生于移植后数月至数年,患者表现为干咳、呼吸困难和发热;但患者肺功能为限制性通气障碍,影像学提示间质纤维化改变,可以此鉴别[35]。慢性阻塞性肺疾病主要表现为干咳、喘息、劳力性呼吸困难等阻塞性通气功能障碍,与BOS患者的临床症状和肺功能改变相似,但患者往往病程长、有吸烟史、高分辨率CT无支气管壁增厚等表现。支气管哮喘为发作性伴有哮鸣音的呼气性呼吸困难,肺功能为阻塞性通气障碍;但其肺功能检查吸入β2受体激动剂(如沙丁胺醇)后FEV1的下降为可逆性。四、BOS的治疗BOS是一种难治性疾病,目前,其治疗在国内外均尚未形成规范化诊疗路径。本共识推荐采用联合用药方案治疗BOS,以延缓患者肺功能恶化,同时减少糖皮质激素的用量(图2)。对于肺功能恶化的难治性患者,可考虑接受肺移植术。除此之外,BOS患者应重视全身支持治疗,包括感染预防、呼吸功能锻炼、严格戒烟、营养支持等。(一)药物治疗1.糖皮质激素:糖皮质激素(泼尼松)联合或不联合钙调磷酸酶抑制剂(CNI)是现今国内外cGVHD治疗的一线方案,但其在BOS中反应率欠佳,仅为20%~40%[36,37,38]。考虑到糖皮质激素的不良反应,建议:与其他药物联用以提高反应率及减少糖皮质激素用量。另外,有小规模的体内外研究显示,霉酚酸酯对于BOS的疗效可能优于环孢素A和他克莫司[39]。2.FAM方案联合糖皮质激素:FAM方案具体用法:吸入性氟替卡松(fluticasone)440μg每日2次;阿奇霉素(azithromycin)250mg每周3次;孟鲁司特(montelukast)10mg每晚1次;泼尼松1mg·kg-1·d-1,维持2周并根据病情每周减量0.25mg·kg-1·d-1,争取5周内减至0.25mg·kg-1·d-1(合并其他GVHD表现而需要更高剂量患者除外)。研究证实该方案治疗3个月可明显改善36%新诊断BOS患者的肺功能,总体反应率达94%,且可显著减少糖皮质激素用量[40,41]。然而,阿奇霉素对BOS的肺功能改善长期疗效尚不明确[42,43],故应根据患者病情决定是否以阿奇霉素作为非活动期BOS的长期用药。推荐:采用系统性糖皮质激素联合FAM方案作为BOS的初始治疗方案[44]。3.布地奈德/福莫特罗吸入方案:布地奈德400μg/d+福莫特罗12μg/d吸入每日2次。轻至重度BOS患者联合吸入布地奈德、福莫特罗并维持原有糖皮质激素或免疫抑制剂方案不变,可在治疗开始后1个月显着改善FEV1,且在6个月的研究期间维持良好疗效[45,46]。建议:可选择布地奈德/福莫特罗联合吸入作为糖皮质激素和(或)CNI的联合治疗方案。4.芦可替尼(ruxolitinib):芦可替尼10mg每日2次,若患者不耐受,可进行剂量调整。芦可替尼是一种JAK1/2抑制剂,可抑制促炎细胞因子和效应T细胞的生成,用于BOS的挽救性治疗可替代糖皮质激素,甚至可能改善部分患者的肺功能[47,48,49,50,51]。建议:芦可替尼可作为BOS的挽救治疗方案,尤其是合并难治性cGVHD的患者。5.其他:酪氨酸激酶抑制剂可通过血小板衍生的生长因子途径抑制纤维化,伊马替尼(imatinib)、尼达尼布(nintedanib)可以抑制BOS患者肺功能的恶化[50,52,53]。吡非尼酮(pirfenidone)已在体内外实验被证实可显著改善肺纤维化[54,55]。另外,选择性Rho关联卷曲螺旋蛋白激酶2(ROCK2)抑制剂belumosudil治疗cGVHD患者BOS可获得20%~30%的缓解率,可能是潜在的BOS挽救治疗新选择[56,57]。建议:在有条件的临床中心,对于初始治疗无效的BOS患者,在充分知情同意情况下,可选用其挽救治疗。(二)间充质干细胞(MSC)输注MSC输注可调节外周淋巴细胞亚群,改善GVHD[58],也有助于改善肺功能[59,60]。MSC用法:1×106/kg每周1次,每4周为一个疗程。建议:在有条件的临床中心,对于BOS初始治疗无效的患者,可根据临床经验和患者病情进行MSC输注临床研究。(三)肺移植对于常规治疗无效且不伴有其他部位严重活动性cGVHD、无复发迹象的严重BOS患者,可以考虑进行肺移植。肺移植术后1~5年生存率可达37%~78%[61,62,63]。患者年龄较低、HSCT后2年血液病未复发、不伴有需使用免疫抑制剂治疗的其他活动性cGVHD、不伴有其他器官功能衰竭与良好的预后有关[61]。建议:对于其他治疗措施无效、原发病持续稳定、且无严重活动性cGVHD的严重BOS患者,在HSCT1~2年后,患者充分知情同意条件下可考虑肺移植治疗。五、BOS的疗效评估推荐采用以下疗效评估标准:治疗反应分为:①完全缓解(CR):治疗后FEV1/预测值比值≥80%;②部分缓解(PR):初始FEV1/预测值<70%,治疗后FEV1/预测值比值绝对值增加10%及以上,但尚未达CR;③疾病稳定(SD):治疗后FEV1/预测值比值绝对值增加10%~减低10%;④疾病进展(PD):治疗后FEV1/预测值比值绝对值减低≥10% [28]。由于BOS的疾病进展性与临床难治性,建议:评估患者维持SD状态则可认为治疗有效[28]。六、BOS的监测BOS患者初治时的肺功能情况(尤其是FEV1降低程度)是影响疗效和预后的重要因素[64]。因此,移植后定期肺功能筛查和BOS早期诊断十分重要。BOS-0p阶段(BOS-0p)定义:FEV1下降>10%或中期气道流速下降>25%,但不符合BOS诊断标准,其对BOS诊断的敏感性高达85%[65]。对于这部分患者,可提高筛查肺功能的频率,监测肺功能进展;同时应尽量控制BOS发生的危险因素,包括积极预防感染、严格戒烟、防止接触物理化学毒物等。七、BOS的预防目前,对于BOS的预防仍处于临床试验阶段。预防性输注MSC可能对预防BOS有益[66],该方案的安全性和有效性尚待进一步研究[67]。有研究显示阿奇霉素在HSCT后早期无助于降低BOS的发生率[43,68]。因此,应谨慎以阿奇霉素作为BOS的预防用药,需密切监测患者的临床表现及肺功能情况。引自:中华血液学杂志,2022,43(6) :441-447.DOI:10.3760/cma.j.issn.0253-2727.2022.06.001
 贾晋松医生的科普号
贾晋松医生的科普号 2023年11月12日
2023年11月12日 241
241
 0
0
 0
0
-
急性淋巴细胞白血病(ALL)的移植适应证与移植时机
ALL在成人和儿童患者中有较大的区别。1、成人ALL第一次完全缓解后异基因造血干细胞移植的适应证年龄:>40岁;诊断时高白细胞:B-ALL:>30×109/L,T-ALL:>100×109/L;高危细胞遗传学:t(9;22)(q34;q11),t(4;11)(q21;q23),t(8;14)(q24;q32),复杂核型,低亚二倍体/近三倍体;预后差的亚型:ETP、BCR-ABL1-like、iAMP21;高危分子遗传学:B-ALL:IKZF1缺失突变;T-ALL:NOTCH1/FBXW7、NRAS/KRAS、PTEN;未能缓解:治疗4周内不缓解的患者;MRD:2个疗程后MRD>1×10-4,MRD持续阳性或阴性转阳性者。2、儿童ALL异基因造血干细胞移植的适应证80%-90%的儿童青少年ALL可通过化疗达到治愈,仅10%-20%儿童青少年ALL患者需要进行Allo-HSCT。儿童由于化疗耐受能力及组织修复能力都比较强,一般都采取MACAllo-HSCT,移植相关死亡率较低,可有效治愈白血病。具有高危细胞遗传学以及对化疗敏感性差者在达到第一次完全缓解后就应该进行移植;复发的T-ALL尤其是小于6个月的早期复发者,应该尽量达到第二次完全缓解后再进行移植;对于难治/复发的疾病通常不建议挽救性Allo-HSCT。可以先通过CAR-T、抗体、靶向药物等使疾病达到完全缓解后再进行移植。3、ALL移植的时机总之,ALL患者应在诱导治疗达完全缓解(CR)后强化4个疗程再进行移植;难治/复发B-ALL采用CAR-T(CD19、CD22)或抗体(CD3/CD19双抗、CD22抗体药物偶联物)等治疗达到CR后移植;难治/复发T-ALL采用CAR-T(CD7、CD5)或抗体(CD38单抗)等达到CR后移植。
吴彤医生的科普号 2023年05月16日
2023年05月16日 498
498
 0
0
 1
1
-
“自体造血干细胞移植”的意义
淋巴瘤和骨髓瘤患者在治疗过程中常常听说“自体移植"这个词。。。。。那么,需要移植吗?图片风险大吗?我们一起来系统了解一下“自体移植”这个神奇的技术吧!什么是“自体造血干细胞移植”今天,我们来介绍一个神奇又有威力的武器---自体造血干细胞移植自体造血干细胞移植,是首先采集自体造血干细胞冻存,在给予大剂量化疗后(预处理),回输自体干细胞支持造血的一种成熟的治疗技术手段。原来,自己不但能为自己加油,还可以给自己提供“造血干细胞”。那么,用“自己的干细胞种子”给自己,为什么称为“移植”呢?因为,这个化疗的强度,是远远超过普通化疗强度的,相当于将造血系统和免疫系统重建了一遍,风险也高一些。。。。所以,有一些淋巴瘤患者面对“自体造血干细胞移植”这个治疗手段的时候,往往会有非常矛盾的心态:当化疗效果好的时候,觉得没有必要冒移植的风险;当化疗效果不好或疾病复发的时候,又会觉得移植是不是也已经不能提高疗效了?之所以会有这样的矛盾心理,最根本的问题还是对自身疾病情况和自体移植这种治疗手段不够了解。要能合理利用自体移植治疗淋巴瘤,首先要对自身所患的淋巴瘤有所认识。怎样的类型需要“自体移植“在发病最初,就需要由医生来准确判断所患淋巴瘤的严重程度和复发风险。如果是高危的淋巴瘤,也就预示着未来的化疗可能会存在效果不好或容易复发的情况,那么一开始就要做好移植的准备。例如(此处敲黑板):双打击的高级别大B淋巴瘤,中枢受累的淋巴瘤,很多外周T细胞淋巴瘤,多发性骨髓瘤等等。这些淋巴来源肿瘤大部分化疗后缓解时间有限,非常容易复发,一旦复发治疗效果不好,所以就要在最开始化疗缓解后进行自体移植来强化治疗。还有一些淋巴瘤起初化疗有效但后来复发,或是化疗有效但难以达到完全缓解的,这时候往往需要自体移植来帮忙强化杀伤肿瘤,争取完全缓解。除了对淋巴瘤疾病本身要有了解外,还要对“自体造血干细胞移植”有一定的认识,才能做出理性的选择。“自体造血干细胞移植”是目前血液肿瘤科一种成熟的治疗手段,是把事先预存好的患者自身的造血干细胞回输给接受很大剂量化疗的患者本人的治疗过程。由于在自身的造血干细胞的支持下,患者可以接受一个大剂量的化疗,被称为“预处理”化疗。对于那些仍对化疗有反应的肿瘤细胞来说,这个剂量的化疗会对肿瘤造成沉重的打击,还会破坏肿瘤生长的免疫微环境,连根端,让肿瘤无处遁形。预处理化疗后,虽然患者的白细胞,血小板会降低到极低的水平,但是输回体内的自体造血干细胞一般会在2周左右重建患者的血液和免疫系统,我们的各种细胞数量和功能就都逐渐恢复啦图片图片,后期也没有排异反应。目前来看,自体移植的安全性和一般的大剂量化疗已经相当,甚至更好,完全没有必要因为恐惧移植而丧失了关键的治疗时机。总之,复发难治的淋巴瘤如果对于化疗还有一定的反应,而身体条件许可的情况下,自体造血干细胞移植仍是目前一种主要的有效的治疗手段。下一期,我们会针对采集干细胞的时机,方法,自体移植的注意事项,逐一给大家解读哦,不要走开哦!
杨帆医生的科普号 2023年01月29日
2023年01月29日 426
426
 0
0
 0
0
-
造血干细胞移植后肺部并发症的预防和诊治
6月14日,高博医学(血液病)上海研究中心上海力泉医院血液科副主任、医学博士李肃主任以线上直播的形式带来关于「造血干细胞移植后肺部并发症的预防和诊治」的科普讲座,并对患友们提出的问题进行答疑解惑。现为大家整理科普答疑的精华内容,供广大患者及家属参考。Q1:造血干细胞移植术后,常见的并发症有哪些?李肃主任: ①自体造血干细胞移植术后主要并发症为:大剂量化疗带来的全身各脏器功能损害、血液毒性反应,以及因血液毒性引发的感染、出血、血红蛋白低引起的相应并发症等等;②异基因造血干细胞移植术后除了以上的并发症外,还会有因细胞植入带来的排异反应,移植后的排异有两种,一种是急性排异,一种是慢性排异。急性排异常见的表现是腹泻、皮疹、黄疸等等;慢性排异可能会发生在全身各个系统,比如关节,口腔,眼睛,肺,肝脏等器官,周期也较长。除此之外,异基因移植需要用到一系列药物,如抗排异药物,也会带来不良反应,常见的有:恶心、呕吐、腹泻等消化道反应,以及中枢反应等。总体来说,异基因造血干细胞移植术后的并发症会比自体造血干细胞移植术后的并发症更多。Q2:从病原学角度看,感染的类型有哪些?李肃主任:常见的感染可分为以下几类:细菌感染、真菌感染、病毒感染,以及一些罕见的病原体感染。细菌感染根据来源分内源性感染和外源性感染,常见的有革兰氏阳性菌、阴性菌;真菌感染常见的有念珠菌、曲霉菌;病毒感染较为常见的有:疱疹病毒、呼吸道病毒;罕见病原体最常见的是寄生虫,往往因进食不当而引发感染。医生会针对不同类型的感染给出不同的治疗方案。Q3:从病原学角度来看,发生肺部感染的时间有区别吗?都是怎样的?李肃主任:造血干细胞移植后,相当一段时期内患者免疫力较低,容易发生各种感染。尽管肺部感染可发生于自体移植之后,但异基因移植后发生率较高、临床表现较重。发生肺部感染的时间可分为几个阶段:移植1个月以内,处于骨髓抑制期,细胞较低、黏膜屏障受损,这段时间内易发生细菌、真菌感染;移植后1-3个月,淋巴细胞功能没有完全恢复,免疫力低下,真菌、病毒感染较常见,;移植3个月后,造血重建、免疫系统逐渐恢复,病毒发生率减少,但仍有发生真菌感染的可能,比如:肺孢子菌,就是一种比较特殊的真菌感染。移植后1年,肺部感染发生率大大降低。Q4:是什么原因导致造血干细胞移植术后感染高发?李肃主任:感染的原因分为两个方面:1.内在因素:移植后,患者造血和免疫系统重建是一个缓慢的过程,造血恢复以后,体内的免疫细胞及功能尚未恢复到正常水平,通常需要6个月甚至1年以后才能重建正常的免疫功能,在这段时间内,移植患者是易发生感染的高风险人群;2.外在因素:移植后感染预防护理非常重要,患者出了移植仓或回家后,注意个人和环境卫生也至关重要。常见的外在因素引发感染如:饮食上吃了不洁食物或不易消化的食物引发肠源性感染,便秘、肛裂引发肛周感染、皮肤抓破或PICC置管创口引发的感染、呼吸道感染或肺部息肉引发的肺部感染,等等。因此,患者自身要做好个人和环境卫生、PICC置管定期维护、注意饮食清洁等等,只有把这些内在因素和外在因素都控制好,才能降低移植后感染的发生率。Q5:肺部感染与肺部排异有相关性吗?李肃主任:肺部感染与肺部排异都是移植术后常见的并发症,在临床的表现有一定的相似性,如发烧、咳嗽、气急等都非常相似,在影像学方面,两者也都会出现磨玻璃样肺部阴影、双肺云雾状阴影、白肺等。从经验上判断,如果患者出现肺部并发症,同时身体其它器官也有排异表现,如:伴有皮疹、腹泻等症状,可考虑为肺部排异。另外,如果患者近期体内免疫抑制剂浓度下降或服用诱导排异的药物也可能诱发肺部排异。尽管如此,肺感染和肺排异的鉴别还是非常困难的,通常是需要认真排除感染后才能诊断肺排异,在各类表现及影像学无法区分的情况下,可采用气管镜肺泡灌洗,通过灌洗液病原学检查来鉴别感染与排异。由于移植后肺部感染与肺部排异的治疗方法完全不同,因此区分两者非常重要。Q6:为什么肺部感染发生率高?李肃主任:引发肺部感染的原因主要有以下几方面,第一是环境因素,如果外界空气中的气溶胶带有病原菌,吸入肺中会容易引发感染;第二是患者身体因素,如果患者本身有肺部慢性基础疾病,如支气管扩张、肺气肿等,则易引发感染。同时,患者移植后免疫力低下,尤其在大剂量化疗后患者可能会出现白细胞低、粒细胞缺乏,在此期间,易引发肺部感染。另外,放射治疗范围内的正常肺部组织会受到治疗影响而发生损伤,引起炎症反应。最后,移植期间使用的部分药物也有诱导肺部感染发生的可能。临床数据表明,异基因造血干细胞移植肺部感染发生率高于自体造血干细胞移植。医生在治疗期间会着重于肺部感染预防以降低感染发生的可能。Q7:病原体是如何侵入肺部引起感染的?李肃主任:病原体来源最常见的是空气中的气溶胶携带致病菌,气溶胶的存在有多种形式,一是受到污染的空气,如空气中扬起的粉尘;二是空调水源,尤其是中央空调的管网、水源需要进行定期的消毒;三是花粉,在血液科病房内不建议送花给患者,因为花粉中可能会携带霉菌,被吸入到患者体内引发感染。除此之外,病原体可能来自人体自身携带的病菌,比如鼻窦炎引发的肺部感染,则需要在治疗肺部的同时将鼻窦炎治好。肠源性感染也易引发肺部感染,放化疗后肠道微生态失衡,主要是肠道屏障受损、肠道菌群种属和数量的失调、肠道菌群和内毒素出现易位等,如肠道内的大肠杆菌、变形杆菌、肠球菌、葡萄球菌等通过血流达到其他部位,造成感染。另外,因中心静脉导管护理不当引发的感染也较为常见,病原体从皮肤创口播散到血液、侵入到肺部,比如:金黄色葡萄球菌肺炎。因此,病原体通过呼吸道、血液、淋巴道等都可以侵入到肺部引发感染。Q8:预防移植中发生感染,有哪些应对措施?李肃主任:早发现、早诊断、早治疗非常重要。感染的常见症状是发热,如果发热超过38℃且伴有发冷、发抖、腹泻、腹痛,考虑为肠道感染;如果发热伴有咳嗽、气急,考虑为肺部感染;如果发热伴有小便痛,考虑为尿路感染。医生会根据患者的症状做相应的检查以找出确切的感染病因与感染部位,再进行针对性用药,及时控制感染,避免感染恶化引发危重症状。因此,及时找到感染病因与感染部位起到至关重要的作用。Q9:患者一旦发生肺部感染,应该如何处理?李肃主任:如果血液病患者出现发烧、咳嗽、胸闷、气急等症状应立即就医,不建议居家自行吃抗生素进行治疗,以免因肺部感染进展太快而错失最佳治疗时机。就医后,除了完善血液系统疾病相关的检查外,还需通过肺部CT检查来评估感染程度、诊断感染类型,与此同时,根据肺部CT结果进行相关治疗。如果肺部CT无法诊断确切病因,需尽快通过气管镜肺泡灌洗细菌培养找到病原体。通常来说,在起病4天内需要完成上述相关检查与治疗,以争取在最快、最短的时间内找出病因、控制感染。Q10:患者移植后,如何降低肺部感染发生率?李肃主任:尽可能切断病因才能降低肺部感染发生率。建议做好以下几点:1.保持环境清洁,居家可配备室内消毒机,外出应避免人流聚集处、并戴好口罩;2.遵循干净、卫生、易消化的饮食原则;3.PICC/PORT置管定期护理、保持清洁;4.清除潜在危险因素、控制自身慢性疾病,如及时进行鼻窦炎治疗、保持鼻腔清洁。5.增强自身免疫力,注意营养均衡、保持适量运动和充足睡眠。6.谨遵医嘱、定期随访。Q11:疫情反复的大背景下,血液病患者防治新冠,有何建议?李肃主任:防,是最重要的。建议患者以居家为主,尽可能减少外出或去往人群聚集的场所并戴好口罩,外出后做好消毒。另外,在病情稳定的情况下,血液病患者也可以接种新冠疫苗。如果血液病患者得了新冠,需及时接受相关治疗、尽快转阴,以避免耽误自身病情的治疗。
 李肃医生的科普号
李肃医生的科普号 2023年01月18日
2023年01月18日 441
441
 0
0
 1
1
-
造血干细胞移植供者的注意事项有哪些呢 ?
亲缘造血干细胞移植供者为病人家属,为保证细胞采集顺利进行,需要做好以下准备:1、采集前签署采集同意书。2、采集前检查:主要检查供者的血常规、血型、血凝、乙肝病毒、丙肝病毒、巨细胞、EBV病毒等,心脏超声、肝胆脾胰超声、心电图等,通过这些检查排除干细胞捐献禁忌症。3、采集前4-5天皮下注射粒细胞集落刺激因子(G-CSF)进行供者干细胞动员。为什么我们要注射动员剂呢?因为正常生理条件下外周的干细胞非常少,不能满足采集需求,通过注射动员剂,可使外周血造血干细胞增加20-30倍以达到采集需求。一般上午下午各打一针,次日抽取血常规看细胞增长情况,多数供者会出现腰痛、关节酸痛、腿部胀痛、乏力困倦感,类似感冒症状,这些都属于正常现象。4、提前1-2天到造血干细胞移植中心评估血管,保护好采集备用的血管,供者采集前一周不要在肘窝部大静脉采血,尤其采集当天不要在此采血;若需要置管,请主管医生联系置管,在采集前一天置管,(置管要求:①置管位置:锁骨下②导管型号:双腔大口径即两侧管腔均为14G),并签署深静脉穿刺同意书。5、采集前排大小便。6、饮食:采集前一天及当天进食清淡、高纤维素及富含钙的食物,少食油脂类食物(如鸡蛋、牛奶、大肉等),以免血清中油脂过多。避免饮酒、抽烟;采集当天,早餐要吃饱(但要少吃流食),切忌空腹,以免引起低血糖反应,影响采集。7、供者采集时由一名家属陪同,采集过程中可能会出现轻微的枸橼酸盐中毒,表现为口唇、颜面及肢端麻木,经静脉滴注10%葡萄糖酸钙后症状会消失。8、一般采集需要5-6小时,需鼓励供者通过看电视、听音乐等方式转移注意力,消除其紧张和恐惧心理。9、采集前病人所在病区护士站将供者转科至造血干细胞移植中心。必要时由主管医生陪同。10、供者住院账户至少缴费10000元。11、采集外周干细胞结束后,按压穿刺处5-10min,待止血后贴上止血贴,24小时内避免淋浴,预防局部感染。采集一周内避免剧烈运动,注意休息,进食高蛋白、高维生素、富含钙和铁的食物,并予采集后15天、60天、一年来院复查,以确保供者的健康。12、供者出院后保证充足睡眠与休息,生活规律,避免熬夜,预防感冒,避免劳累和重体力劳动,选择有氧运动,循序渐进。关注有无持续性头晕、头痛、心悸、气促、全身疼痛等,必要时及时就诊。遵医嘱按时、按量、按疗程正确服药,不可自行更改或者停药,注意观察服用药物后有无不良反应,及时到医院复查血常规。刘健教授坐诊时间:南院区周一上午;河医院区周四上午周五下午周日上午。
 儿科骨髓移植刘医生的科普号
儿科骨髓移植刘医生的科普号 2023年01月13日
2023年01月13日 2359
2359
 0
0
 3
3
-
造血干细胞移植患儿入仓后陪护应如何护理
药浴:入仓时患儿及陪护各药浴约20-30分钟,注意清洗皮肤皱褶处。药浴后切记不可乱摸,如:门把手,墙面等。由护士给予戴好口罩帽子后领入病房。每日准确测量体重和腹围:最好是晨起、空腹、解便后,着单薄衣服称体重。测腹围,患儿平躺掀开衣服绕肚脐一周测量,以便医生护士判断病情变化。每日记录出入量:患儿进食的开水、食物、牛奶、水果等,排泄物,包括大小便、呕吐物等称重并记录。饮食:1、以新鲜、清淡、易消化,避免油腻粗糙和刺激性食物为原则,如瘦肉、剔刺的鱼肉、胡萝卜、土豆、绿叶蔬菜等。2关于水果,患者在预处理及移植早期、后期,水果需清洗干净后煮熟。特别是移植早期尽量不吃水果。皮肤护理:患儿及陪护每日洗必泰溶液擦浴全身并更衣。口腔护理:1、餐前、餐后、睡前、晨起均要用漱口水含漱3-5分钟。2、口腔溃疡时进食温凉流质、半流质,如粥、烂面条、蔬菜汁、蛋羹。肛门会阴部的护理:1、养成每日定时排便,便后及时清洗,每日坐浴的习惯。如有腹泻,肛周皮肤可涂抹百多邦软膏或金霉素眼膏保护皮肤。2、如肛周皮肤发红,局部可吉尔碘消毒后涂抹百多邦软膏或金霉素眼膏,尽量减少使用尿不湿。中央静脉导管的护理:1、避免颈部大幅度转动,以防缝线断裂。2、妥善固定导管,用发带将导管固定颞部,防止脱出。3、防止导管扭曲、受压。4、保证导管通畅,观察导管有无回血,特别是患儿有咳嗽或烦躁时可能回血,如有回血,立即通知护士冲管。5、敷料如有潮湿、卷曲、脱落、污染等情况通知护士更换。化疗药物:如化疗药物等副作用为恶心、呕吐及白细胞减低等,药物停用或减量后可以消失。静脉输注前医生会以止吐药。化疗期间尽量多饮水,多排尿。卫生习惯1、患儿和陪护应该勤洗手,尤其是餐前、便后。2、保持病室整齐,带入层流病房物品尽量从简,物品放入床头柜或者壁柜内。3、保持病室清洁,垃圾入桶、加盖,每日清理垃圾出室至少2次,封紧袋口,地面如有呕吐物污染及时清洁、消毒。刘健教授坐诊时间:南院区周一上午;河医院区周四上午周五下午周日上午。
 儿科骨髓移植刘医生的科普号
儿科骨髓移植刘医生的科普号 2023年01月10日
2023年01月10日 1512
1512
 0
0
 2
2
-
肿瘤患者新冠“阳性”后,如何重启治疗?
肿瘤病人往往存在免疫系统受损,特别是仍处于治疗周期内的病人更是各种感染的易感人群。新冠流行期间,如何安排好肿瘤治疗,特别是发生感染后何时重启抗癌治疗?这成为很多病友和家属共同关心的问题。根据中国、美国、欧洲的相关研究和共识,相关推荐意见拔萃,同时奉上关于疫苗接种的问题供参考,请谨遵医嘱执行。治疗重启,需要综合衡量新冠感染的风险和感染严重程度,同时,也要充分考虑肿瘤本身进展和肿瘤治疗相关风险。对于符合治疗条件的患者,应尽量恢复治疗。必要时可以结合患者情况和治疗方案的副作用谱,调整方案或减量。NCCN指南推荐,新冠病毒(SARS-COV-2)检测阳性的肿瘤患者,建议推迟抗肿瘤治疗。中国专家共识推荐,新冠病毒感染的肿瘤患者在相关症状完全缓解,间隔24小时连续2次新冠病毒核酸检测阴性,可考虑重启抗肿瘤治疗。化疗,无症状患者在持续无症状至少10天后可以考虑恢复治疗。如有轻中度症状,则至少暂停14天。靶向治疗、免疫检查点抑制剂、免疫治疗、激素治疗,建议至少暂停治疗10天。如为有症状感染,应该在不使用退热药情况下,体温平稳至少24小时。此类治疗不易长期中止。对造血干细胞移植或CAR-T等细胞治疗的肿瘤患者,一旦感染,至少暂停治疗14天以上。对于重症感染的患者,无论何种治疗均需要暂停至少20天。疫苗对肿瘤患者是安全的,ESMO的研究表明,即使在治疗期间也可以安全的接种疫苗。疫苗接种对肿瘤患者能够起到保护作用。只要没有其他禁忌,肿瘤患者应该尽快接种疫苗。中国抗癌协会(CACA)《新型冠状病毒肺炎疫情期间实体肿瘤患者防护和诊治管理相关问题中国专家共识(2022版)》《美国国家癌症综合网络(NCCN)癌症相关感染的预防和治疗指南2022.3版》欧洲肿瘤学会ESMO,2021年会的有关研究报道
 赵岩医生的科普号
赵岩医生的科普号 2022年12月21日
2022年12月21日 422
422
 0
0
 4
4
-
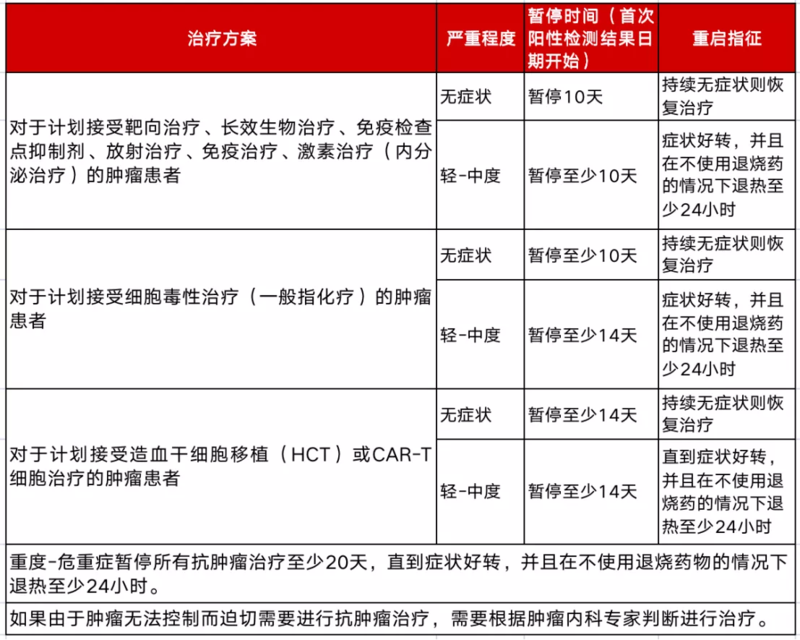
问:肿瘤患者阳性了要不要推迟治疗?密接的肿瘤患者是不是也要推迟治疗?
答,记住两点即可:1、NCCN指南推荐,新冠病毒(SARS-COV-2)检测阳性的肿瘤患者,建议推迟抗肿瘤治疗;2、根据美国疾病控制与预防中心的建议,与已知感染新冠病毒的人密切接触(在1.83米内,24小时内接触时间≥15分钟)的人被称为新冠显著暴露。NCCN指南推荐:有新冠显著暴露的无症状肿瘤患者,自接触日起,抗癌治疗应推迟14天。
 王昆医生的科普号
王昆医生的科普号 2022年12月17日
2022年12月17日 109
109
 0
0
 0
0
相关科普号

刘芳医生的科普号
刘芳 副主任医师
医生集团-四川
血液科
3363粉丝4.4万阅读

郭旭峰医生的科普号
郭旭峰 副主任医师
上海市胸科医院
胸外科
3683粉丝12.3万阅读

陈善闻医生的科普号
陈善闻 副主任医师
复旦大学附属华山医院
泌尿外科
3.8万粉丝1181.8万阅读
-

 推荐热度5.0刘芳 副主任医师医生集团-四川 血液科
推荐热度5.0刘芳 副主任医师医生集团-四川 血液科白血病 57票
骨髓移植 9票
再生障碍性贫血 6票
擅长:白血病,再生障碍性贫血,造血干细胞移植,CarT 治疗,骨髓增生异常综合征,ITP, 贫血,白细胞减少,血小板减少,多发性骨髓瘤,恶性淋巴瘤 -
 推荐热度4.9卢岳 主任医师河北燕达陆道培医院 造血干细胞移植科
推荐热度4.9卢岳 主任医师河北燕达陆道培医院 造血干细胞移植科骨髓移植 7票
白血病 3票
血液病 1票
擅长:2004年加入道培集团,主攻方向为异基因造血干细胞移植治疗难治复发急性白血病、再生障碍性贫血,老年白血病、骨髓增生异常综合征、以及移植后复发患者的二次移植、少见疾病阵发性睡眠性血红蛋白尿,母细胞性浆细胞样树突状细胞肿瘤等具有丰富经验、截止至2024年底,已积攒1800多例移植病例,所经治患者生存率将近80%。其中,半相合移植患者最大年龄为73岁,最小年龄移植患者为1岁半。 -
 推荐热度4.6吕萌 副主任医师北京大学人民医院 血液病研究所
推荐热度4.6吕萌 副主任医师北京大学人民医院 血液病研究所白血病 17票
骨髓移植 5票
血小板减少性紫癜 4票
擅长:CAR-T细胞治疗(难治复发T/B/髓系 急性白血病,淋巴瘤),急性白血病(移植 化疗选择),MDS、慢性粒单(CMML)白血病,骨髓移植合并症(慢性排异等),血小板减少和出凝血疾病,贫血,白细胞减少。




