精选内容
-
“神秘而独特”的甲状腺髓样癌,你了解吗?
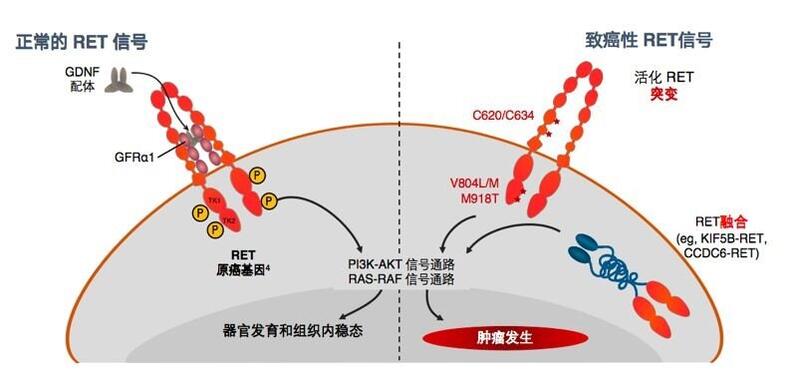
近30年来,甲状腺癌的发病率快速增长,2020年全球癌症负担数据显示,甲状腺癌已经成为全球第九高发的恶性肿瘤,在女性中更是高居前五。而甲状腺癌“大家庭”中有一个极为特殊的成员——甲状腺髓样癌(Medullary thyroid carcinoma,MTC),它组织来源独特,临床表现变化多端,家族聚集倾向明显,复发转移比例较高,相对较难治愈。而由于MTC较为罕见,大众对其认知仍然严重不足。接下来,我们将带您简单了解一下“神秘而独特”的甲状腺髓样癌。 1.病因 MTC可以分为遗传性(~25%)和散发性(~75%)两种。几乎所有的遗传性MTC均由RET基因的胚系突变引起,而散发性MTC约有50%的病人由RET基因的体细胞突变导致,另有10%-20%的病人由RAS基因突变引发。RET基因测序可以帮助判断MTC的病因和遗传倾向。 2.临床表现 MTC起源于甲状腺癌中具有神经内分泌功能的滤泡旁细胞(C细胞),所以它是一种神经内分泌肿瘤。由于恶变的C细胞可以分泌降钙素,癌胚抗原(CEA)等多种生物活性物质。因此MTC患者除了颈部肿块外,还可能伴有面色潮红、心悸、腹泻、手足抽搐等类癌综合征。也有一部分病人因为体检发现CEA增高,消化道各项检查均未发现异常之后,才发现元凶是MTC。而遗传性MTC患者除上述临床表现外,往往还有家族聚集性发病的倾向,并可能同时伴有肾上腺嗜铬细胞瘤、甲状旁腺增生、先天性巨结肠、黏膜神经节瘤等全身病变。综上,MTC的临床表现十分复杂多样,往往需要有经验的专科医生才能做出准确判断。 3.预后 早期MTC预后良好,5年生存率可达95%以上。但相比于甲状腺乳头状癌,MTC恶性程度整体较高。一旦MTC患者的原发灶侵犯毗邻器官(如气管、食道、喉返神经等)、或出现颈部/纵隔淋巴结的广泛转移,则手术难度骤然增大,肿瘤复发风险显著增高,往往难以达到生化治愈(降钙素、CEA低于正常值上限)。若出现远隔器官(肝、肺、骨)的转移,则提示预后不良。因此,早期发现和治疗对于MTC的转归和预后至关重要。 4.治疗 MTC虽也可归类于神经内分泌肿瘤(Neuroendocrine tumors,NETs),但与其他较常见胃肠道、肺、胰腺等部位的NETs治疗有较大区别。手术目前仍然是治愈MTC的唯一可能的手段。与分化型甲状腺癌的手术不同,MTC的手术方式不仅需要参考病人的肿瘤累及范围、也需要同时考虑肿瘤的遗传性和生化指标(如降钙素)等,而对于伴有肾上腺嗜铬细胞瘤的遗传性MTC患者,则需要根据嗜铬细胞瘤的功能来综合考虑手术顺序及风险。伴有遗传性RET基因突变的幼儿,甚至可能会考虑进行预防性甲状腺切除手术。MTC的手术治疗经常涉及广泛的颈部或上纵隔清扫,手术范围有时也会包括气管、食道、神经等重要毗邻结构,对外科医生的手术技巧、解剖知识、疾病的认知程度要求较高,因此,我们推荐MTC患者前往专科化程度较高的高容量甲状腺肿瘤诊治中心就诊。 对于局部晚期或已出现远处转移的MTC患者,可选择的治疗手段极其有限,放疗、化疗、同位素、生长抑素等治疗方式对该疾病均无明显效果。国内获批MTC适应症的靶向药物为安罗替尼,而卡博替尼和凡德他尼这两种药物目前均未在中国大陆上市。近两年来,两种高选择性强效RET抑制剂BLU-667和LOXO-292在治疗晚期RET突变型MTC的临床试验中取得了令人惊艳的治疗效果,并且均已被美国FDA批准上市。而在国内,这两种药物也正在几家大型甲状腺癌诊疗中心开展临床试验,为国内的RET突变型MTC患者带来新的希望。 【科室介绍】 复旦大学附属肿瘤医院头颈外科作为国内乃至国际最大的甲状腺癌诊治中心之一,每年甲状腺恶性肿瘤手术量超过7600台,对于包括MTC在内的甲状腺癌诊治具有丰富的经验,诊疗效果与国际顶级肿瘤中心持平。2020年,科室作为牵头单位编写了国内第一个MTC诊疗专家共识——《2020版甲状腺髓样癌诊断与治疗中国专家共识》,对国内MTC诊疗的规范化和标准化作出了重要贡献。同时,科室多年以来坚持与倡导多学科协作(MDT)模式,能够为包括MTC患者提供规范的诊疗:如精准肿瘤中心可以为MTC患者提供精准靶向测序,帮助患者判断疾病遗传倾向与病因;病理科能够提供准确的石蜡病理和分子病理诊断;核医学科通过新型显像技术,能够更准确地示踪隐匿复发转移病灶等。从而为患者提供个体化的综合治疗。此外,科室牵头或参与了多项国际、国内靶向、靶向/免疫联合的多中心或单中心临床试验,包括了前文介绍的多项针对髓样癌的多靶点或高选择性靶向药物临床研究,也将为相关晚期MTC患者带来新的希望。
 王宇医生的科普号
王宇医生的科普号 2022年02月20日
2022年02月20日 2080
2080
 0
0
 4
4
-
指南与共识|甲状腺髓样癌诊断与治疗中国专家共识(2020版)
甲状腺癌病人中,90%以上为分化型甲状腺癌(differentiated thyroid cancer,DTC),而甲状腺髓样癌(medullary thyroid carcinoma,MTC)的发病率较低,且有其独特的临床病理特征,故而误诊、漏诊和不规范治疗现象仍然普遍存在。 MTC是起源于甲状腺滤泡旁细胞(C细胞)的恶性肿瘤。C细胞属于APUD系统,具有合成分泌降钙素(calcitonin,Ctn)及降钙素基因相关肽的作用,因此,MTC亦被认为是神经内分泌肿瘤之一。MTC在临床分型、诊断、治疗、随访及预后等多个方面与DTC均有所差异,故包括美国甲状腺协会(ATA)在内的多个机构都针对MTC制订了独立的临床诊治指南。为进一步提高我国MTC的诊治水平并提供更加合理及规范的诊治方案,中国医师协会外科医师分会甲状腺外科医师委员会、中国抗癌协会甲状腺癌专业委员会、中国研究型医院学会甲状腺疾病专业委员会结合近年来MTC领域的最新临床研究成果和国内实际的诊治现状,特制定本共识。 1 MTC的分类及流行病学 根据疾病的遗传特性,将MTC分为遗传性和散发性两大类。几乎所有的遗传性MTC(hereditary medullary thyroid cancer,HMTC)都伴有RET基因的胚系突变,50%的散发性MTC有RET基因的体细胞突变[1]。散发性MTC发病率较高,占发病总数的75%~80%;遗传性MTC则多以多发性内分泌肿瘤综合征2型(MEN2)中的一部分发病,根据最新的ATA甲状腺髓样癌临床指南描述,可分为多发性内分泌腺瘤2A(MEN2A)和多发性内分泌腺瘤2B(MEN2B)。 1.1 MEN2A 约占所有MEN2病人的95%,又可分为4个亚型。 1.1.1 经典型MEN2A 最为常见,除了MTC外还可并发嗜铬细胞瘤和(或)甲状旁腺功能亢进(hyperparathyroidism,HPTH)。95%的病人RET基因突变在10号外显子的第609、611、618、620以及11号外显子的第634密码子[2]。 1.1.2 MEN2A伴皮肤苔藓淀粉样变(CLA) CLA的典型临床表现为脊柱T2-T6对应的背部肩胛区皮肤病损和瘙痒[3],几乎所有该类病人均携带RET基因第634密码子突变[4]。 1.1.3 MEN2A伴先天性巨结肠(HD) 约占MEN2A的7%[5],一般由于RET基因10号外显子突变所致[6]。 1.1.4 家族非多发性内分泌肿瘤性MTC(FMTC) 即携带RET基因胚系突变但不合并嗜铬细胞瘤或HPTH的FMTC。 1.2 MEN2B 以MTC并发黏膜多发性神经瘤为特点,50%的病人还可伴有肾上腺嗜铬细胞瘤(pheochromocytoma,PHEO),一般不伴有HPTH。除此之外大部分病人还可表现为Marfan征外貌、眼部异常、骨骼畸形、消化道梗阻及其他临床表现。该类型恶性程度最高,早期即可发生淋巴结甚至远处转移。95%的MEN2B病人携带RET基因第16号外显子M918T突变,不足5%的病人携带15号外显子A883F突变[7]。 2 RET基因筛查、遗传咨询及干预时机 2.1 RET基因筛查和遗传咨询 临床上1%~7%的散发性MTC病人实际具有遗传性MTC的基因背景,因此,散发性病例行基因筛查可进一步明确疾病分型[8]。对于MTC基因筛查的目的主要有两方面:(1)在家系成员中排查特定种类的遗传性MTC。(2)根据不同的突变位点进行危险分层,以期有针对性地制定治疗策略。对于遗传性MTC病人,应常规告知病人,遗传性RET突变可能给家庭成员带来的风险,育龄的RET突变携带者,尤其是MEN2B型,建议进行孕前或产前的遗传咨询。 推荐1:对于以下人群可推荐进行RET基因筛查和遗传咨询:(1)散发性MTC病人本人。(2)遗传性MTC病人本人及一级亲属。(3)在儿童或婴儿期出现MEN2B表现病人的父母。(4)皮肤苔藓淀粉样变的病人。(5)先天性巨结肠病病人,携带RET基因10号外显子突变。(证据等级:D;推荐等级:B) 推荐2:进行RET基因筛查的具体目标位点包括:(1)MEN2A的基因筛查。需要检查的RET基因突变位点主要包括10号外显子的第609、611、618、620密码子、11号外显子的第630、634密码子。若上述检查未发现明确的突变位点,或临床表型与检查结果不一致时,应进一步采用RET基因编码区全测序进行筛查。(2)MEN2B的基因筛查:需要检查的RET基因突变位点主要包括16号外显子的M918T突变和15号外显子的A883F突变,若结果为阴性则行需要RET基因编码区全测序。(证据等级:D;推荐等级:A) 推荐3:除计划使用选择性RET抑制剂治疗晚期MTC外,不常规筛查MTC病人的体系RET突变。(证据等级:D;推荐等级:B) 推荐4:在十分罕见的家系中,会出现受检者符合MEN2A或MEN2B临床诊断标准,但整个RET编码区均没有基因突变的情况。这种情况下有风险的亲属应当采用传统的筛查MTC、嗜铬细胞瘤以及HPTH的方法来进行阶段性检查。(证据等级:D;推荐等级:B) 2.2 基于RET突变位点的危险度分层 目前发现与遗传性MTC有关的RET基因突变、插入、缺失位点>100个,而导致肿瘤发病的常为单点突变,少见双点甚至多点突变。不同类型的MTC对应不同的RET基因突变位点,不同的突变位点所致肿瘤的恶性程度亦不相同。 推荐5:对于遗传性MTC根据不同的突变位点进行风险分层。可分为3级:(1)最高风险(HST)。包括MEN2B病人和RET密码子M918T突变。(2)高风险(H)。包括RET密码子C634突变和A883F突变。(3)中等风险(MOD)。包括遗传性MTC病人中除M918T、C634、A883F突变之外的病人。(证据等级:D;推荐等级:B) 2.3 遗传性MTC的干预时机 2.3.1 MEN2A儿童遗传性MTC的预防性甲状腺切除 高风险类别儿童通常在出生后几年就发展为MTC,因此,应从3岁开始每年进行查体、颈部超声和血清Ctn水平检查[9]。中风险类别的儿童通常稍年长时发展出侵袭性较低的MTC[10],因此,建议中风险类别儿童从5岁起每年进行体检,行颈部超声和Ctn检查。 高风险类别儿童应在5岁之前进行甲状腺切除术,并根据Ctn水平指导手术时间和范围。中风险类别的儿童应在儿童期或成年期进行甲状腺切除术,手术时间主要取决于Ctn水平。一项纳入14例MEN2A患儿的回顾性研究表明,即使患儿已出现微小(≤1 cm)的MTC病灶,预防性全甲状腺切除术一般已足够安全可靠[11]。 2.3.2 MEN2B儿童遗传性MTC的预防性甲状腺切除 对于MEN2B和携带RET密码子M918T突变的极高风险病人,应尽早行甲状腺切除术。最近的一项纳入345例MEN2B病人的全球多中心回顾性研究显示,在1岁以前行甲状腺切除术能够显著降低复发风险[12]。因此,极高危类别婴儿出生后应立即进行基因检测,具体干预时间由外科医生或儿科医生与患儿父母沟通决定。 推荐6:MEN2A/B患儿在充分评估手术获益与并发症风险的基础上,可考虑早期手术干预。具体治疗措施应与患儿监护人充分沟通。(证据等级:C;推荐等级:C) 推荐7:极高风险类别中具有RET密码子M918T突变的患儿,推荐干预时间为出生的第一年内进行甲状腺切除术。术者应与患儿监护人协商,决定行甲状腺切除术的时机。开展首例手术时,应获得所在医院伦理委员会审批通过。(证据等级:C;推荐等级:C) 推荐8:高风险类患儿推荐干预时间为5岁或更早时行甲状腺切除术,具体时机取决于是否发现肿瘤形成及血清Ctn升高的水平。(证据等级:C;推荐等级:B) 推荐9:中风险类别的患儿推荐从5岁开始进行体格检查,颈部超声和血清Ctn水平检测。行甲状腺切除术的时机应取决于是否发现肿瘤形成及血清Ctn升高的水平。(证据等级:C;推荐等级:B) 注:以上与预防性手术的相关推荐,因国内文献极少,主要参考国外MTC指南。考虑中国实际国情,国内缺乏相关经验,亦缺乏相关的法律条文指引,建议在与患儿监护人充分沟通后方可参考。 3 MTC的初始诊断评估 3.1 MTC的生物标记物检测 3.1.1 Ctn Ctn是一类多肽类激素,主要由甲状腺滤泡旁C细胞表达并分泌释放,故在MTC病人中特征性地表达。多个大样本前瞻性非随机对照研究证实,对甲状腺结节病人常规筛查血清Ctn能提高MTC的检出率及总体存活率[13]。我国学者的一项大型回顾性研究显示血清Ctn对于诊断MTC的灵敏度、特异度均较高,同时其检测费用相对较低[14]。我国于2017年发布的《甲状腺癌血清标志物临床应用专家共识》[15]推荐对于怀疑恶性的甲状腺肿瘤病人,术前应常规行血清Ctn检测。 考虑检测方法的差别及更新,血清Ctn尚无统一的参考范围。2015年ATA颁布的MTC诊治指南建议各诊疗单位可根据大样本对比研究确定各自的参考值范围,并强调对于同一病人病情判断,应采用与基线一致的检测方法(注:考虑到不同文献报道中Ctn的检测方法与参考范围亦存在差异,因此本共识中所有提及的Ctn具体数值均以相关的参考文献为准)。 Ctn在肝脏和肾脏中代谢,其表达水平主要受血钙浓度的调节。须注意的是,血清Ctn水平可以受生理作用、病理作用、药理作用等多方面因素的影响。另外,对于肿瘤负荷较大,而血清Ctn阴性的病人,须注意免疫分析法的“脱钩现象”导致的假阴性可能。 推荐10:对于怀疑恶性的甲状腺肿瘤病人,术前可考虑常规检测血清Ctn以对MTC进行筛查。(证据等级:C;推荐等级:A) 推荐11:由于各大中心采用的检测方法不同,在对同一MTC病人进行血清Ctn监测时,建议采用与基线相同的检测方法。(证据等级:C;推荐等级:B) 推荐12:国人对于预防性甲状腺手术接受率低,基因筛查普及率低。因此,对HMTC 家系突变基因携带者需采取密切影像学及血清Ctn变化随访。(证据等级:C;推荐等级:B) 推荐13:术前血清Ctn的升高水平与MTC病人体内肿瘤负荷相关,结合影像学检查有助于评估病情及制定治疗决策。(证据等级:C;推荐等级:C) 3.1.2 癌胚抗原 除Ctn外,C细胞也能分泌癌胚抗原(carcinoembryonic antigen,CEA),因此,MTC病人的CEA水平也可能升高。尽管CEA的特异性不强,无法作为一个理想的MTC筛查指标,但一经诊断为MTC,仍建议同时检测血清Ctn和CEA浓度作为诊断和随访指标。部分MTC病人可表现为血清Ctn和CEA均低表达(非分泌型MTC)。一项纳入839例散发型MTC病人的研究中,非分泌型MTC病人占0.83%。该类病人肿瘤分化差、Ki-67较高、M918T突变更多见[16]。 推荐14:对于MTC诊断明确的病人,建议在术前同时检测血清Ctn和CEA水平。以CEA升高为首发症状就诊的病人,在排除消化道肿瘤后,建议补充Ctn及颈部超声检查。(证据等级:C;推荐等级:A) 推荐15:CEA升高程度与肿瘤外侵、淋巴结转移和远处转移呈正相关,可与 Ctn一起用于评估疾病风险。(证据等级:C;推荐等级:B) 推荐16:CEA升高与MTC肿瘤去分化相关,可作为根治术后监测肿瘤进展指标。(证据等级:C;推荐等级:B) 3.2 辅助检查 3.2.1 颈部超声检查 超声检查是评估甲状腺恶性肿瘤最重要的影像学手段,首选用于甲状腺结节和颈部淋巴结的定性诊断。超声下MTC和转移性颈淋巴结的声像图特征大多和DTC类似。尽管超声检查与操作者的经验密切相关,但与增强CT相比,超声检查的敏感度、特异度和准确率均高于增强CT。 推荐17:建议对所有的MTC可疑病人进行全面的病史收集、体格检查和颈部超声检查。(证据等级:C;推荐等级:A)。 3.2.2 MTC的细针穿刺活检 B超引导下细针穿刺活检(fine needle aspiration,FNA)是重要的术前病理学诊断手段[17]。国内外相关指南中,甲状腺结节的穿刺指征类似,可参考我国发布的《超声引导下甲状腺结节细针穿刺活检专家共识及操作指南(2018 版)》[18]。在此基础上,若出现血清Ctn/CEA水平异常升高,穿刺指针可更加积极。穿刺冲洗液的Ctn检测以及免疫组化染色有助于提高MTC的确诊率[19]。 推荐18:在现有各大指南针对甲状腺结节的穿刺指征基础上,当出现CEA、Ctn升高时,细胞学检查应更为积极。(证据等级:C;推荐等级:C) 3.2.3 RET突变检测 MTC病人中RET基因突变最为常见,且不同突变位点对应不同的临床行为和预后特点。前文已述,可根据RET基因突变位点的不同,对HMTC进行基因筛选、遗传咨询并据此确立早期干预策略(详见“分子检测与遗传咨询”部分)。而对于散发性MTC,目前已有观点认为,基于不同突变位点的危险分层体系在将来同样可应用于散发性MTC的精细化诊治,但现阶段证据仍然不足。高选择性RET抑制剂的出现,显然将加速该观点的推进。 推荐19:RET基因检测对散发型MTC病人危险分层以指导诊治具有重要价值。可以结合病人个体化需求及操作可行性,实施MTC基因分型检测。(证据等级:C;推荐等级:C) 3.2.4 其他辅助检查 多数研究者及指南认为应在术前对MTC病人进行系统性的影像学评估。CT对颈部、纵隔淋巴结病变及肺转移灶敏感[20]。MRI对判断肝脏转移灶更为有效,同时轴位MRI和骨显像是最常用且最敏感的骨转移评估方法。 核医学显像方面,99mTc-MDP骨显像可用于骨转移灶的排查。另外,18F-FDG PET-CT和18F-DOPA也可用于MTC转移灶的评估,但由于检测灵敏度较低且价格昂贵,ATA指南不推荐两者作为远处转移的常规检查手段。但当血清Ctn升高或血清Ctn倍增时间缩短时,18F-FDG、18F-DOPA和68Ga-生长抑素受体显像可考虑用于评估MTC病人的复发/转移[21]。 除评估肿瘤累及范围外,还须仔细检查MTC病人是否合并PHEO和HPTH,尤其是对HMTC病人,避免手术麻醉风险。 推荐20:MTC病人术前须接受系统性的影像学评估,明确肿瘤累及范围,为后续治疗提供客观依据。(证据等级:C;推荐等级:B) 推荐21:PET-CT对术前分期的作用有限,当血清Ctn浓度较高或血清Ctn倍增时间较快时,18F-FDG、18F-DOPA和68Ga-生长抑素受体显像可用于评估MTC病人的复发/转移。(证据等级:C;推荐等级:C) 推荐22:对于确诊MTC者,应常规筛查是否合并肾上腺嗜铬细胞瘤和甲状旁腺功能亢进症。(证据等级:C;推荐等级:B) 4 初治可手术MTC的临床治疗 4.1 MTC的外科治疗 手术是目前首选且惟一被证明可以治愈MTC的方法,传统的放化疗则对本病疗效不佳。针对DTC的放射性碘治疗同样不适用于本病病人。对于合并甲状腺外病变的病人,相关治疗应同步进行。 4.1.1 原发灶手术治疗 目前国内外对HMTC的原发灶治疗的意见趋于统一。即无论是否存在远处转移病灶,对于原发灶可手术的病人,全甲状腺切除术均应作为初始的手术治疗方式。 而对于散发性MTC病人,由于其较高的多灶和双侧发病概率,主流意见仍推荐将全甲状腺切除作为初始的手术治疗方式。少部分中心认为对于术前彩超及影像学检查仅考虑单侧且病灶较小的散发性病人,可考虑行患侧腺叶加峡部切除术[22]。针对此种意见,目前尚缺少足够的循证医学证据,需要大样本临床研究数据支持。 推荐23:对于基因检测已明确或有明确家族史的HMTC,无论肿瘤大小,单侧还是双侧病灶,均应行全甲状腺切除术。(证据等级:C;推荐等级:A) 推荐24:对于基因检测已明确的散发性MTC,可行全甲状腺切除术;此类病人若病灶局限于单侧甲状腺,且无其他危险因素时可行腺叶切除术全甲状腺切除术。(证据等级:D;推荐等级:B) 推荐25:对于未行基因检测、无明确家族史的MTC,建议行全甲状腺切除术。(证据等级:C;推荐等级:C) 4.1.2 颈部淋巴结转移灶手术治疗 4.1.2.1 中央区淋巴结清扫的指征 无论是散发性或HMTC,cN1a病人均应行治疗性中央区淋巴结清扫。对于cN0病人,目前国外各大指南均推荐在全甲状腺切除的基础上行双侧预防性中央区清扫术(prophylactic central neck dissection,PCND)。这一结论基于:(1)无论肿瘤大小,MTC的中央区淋巴结转移发生率均较高(50%~75%)。(2)术前和术中对于中央区淋巴结评估的准确率并不令人满意[23]。(3)回顾性研究显示PCND有助于改善病人预后。 4.1.2.2 侧颈淋巴结清扫的指征 对于所有MTC病人,cN1b均提示须行治疗性侧颈淋巴结清扫,而对于cN0病人的预防性侧颈清扫,则仍存在争议。有研究表明,侧颈淋巴结转移率与颈中央区淋巴结转移数量密切相关,≥4枚中央区淋巴结转移时,同侧侧颈淋巴结转移率最高可达到98%[24]。术前基础血清Ctn水平也可部分反应淋巴结转移程度[25]。 推荐26:cN0的MTC病人建议行预防性中央区淋巴结清扫。(证据等级:C;推荐等级:A) 推荐27:大多数cN0的MTC病人无须行预防性侧颈淋巴结清扫,但仍须结合中央区淋巴结转移情况、血清Ctn水平和原发灶负荷等因素综合考虑。(证据等级:C;推荐等级:D) 推荐28:(1)对于术前淋巴结分期为cN1a的MTC病人,应行中央区淋巴结清扫。(2)对于术前淋巴结分期为cN1b的MTC病人,应行侧颈区和中央区淋巴结清扫。(证据等级:C;推荐等级:A) 4.1.2.3 上纵隔淋巴结清扫 推荐29:对于中央区淋巴结较大或较多者建议行选择性上纵隔清扫,对于有明确的上纵隔淋巴结转移证据的病人,须根据临床特征进行区别处理。(证据等级:C;推荐等级:B) 4.2 MTC的外放射治疗 MTC局部复发的危险因素主要包括甲状腺外侵犯、术后病灶残留、临床分期晚、淋巴结阳性和纵隔受侵[26]。当初始手术治疗无法达到根治目的时,可以考虑应用外放射疗法(EBRT)进行治疗以提高局部控制率。但目前尚无令人信服的证据证明术后EBRT对 MTC病人的总存活率的影响。 与此同时,适当的EBRT可应用于转移性MTC的姑息治疗,例如疼痛性骨转移、纵隔或肺部转移引起的呼吸困难或咯血症状、保护颈部重要结构等。 推荐30:当病人局部复发风险较高时,可考虑对颈部和(或)纵隔区进行外照射放疗。做出EBRT治疗决策前,应综合考虑治疗带来的获益和副反应。(证据等级:C;推荐等级:C) 4.3 术后激素替代治疗 全甲状腺切除术后病人应常规给予甲状腺素替代治疗。由于滤泡旁细胞肿瘤不依赖促甲状腺激素,并且没有证据显示TSH抑制疗法可降低MTC病人术后的复发率或提高存活率,所以MTC行全甲状腺切除术后无须对TSH水平进行过度抑制。 推荐31:术后采用左旋甲状腺素行甲状腺功能的替代治疗,仅当合并DTC时,按照DTC风险分层进行TSH抑制处理。(证据等级:C;推荐等级:C) 4.4 术后放射性碘治疗 MTC病灶并不摄碘,有研究认为术后131I可以通过摄碘的甲状腺组织对MTC细胞达到间接辐射作用,或通过消除残余的甲状腺组织来达到减少复发的目的[27],但近期研究显示MTC病人的术后131I治疗并未降低其疾病特异性死亡风险,不推荐MTC病人行术后131I治疗。然而,对于MTC同时伴有DTC的病人,应结合其DTC部分的临床病理特征决定是否使用131I治疗。 推荐32:对于不伴有DTC的MTC,不推荐行131I同位素治疗。(证据等级:C;推荐等级:B) 4.5 伴有PHEO的MEN2A和MEN2B病人的治疗 推荐33:MEN2病人一经确诊,建议尽早行PHEO的筛查,筛查方法可包括血浆肾上腺素和去甲肾上腺素检测,24 h尿儿茶酚胺检测,以及肾上腺CT和(或)MRI等。(证据等级:C;推荐等级:C) 推荐34:MEN2A和MEN2B病人在行任何手术之前,均应行相关检查排除PHEO。女性病人备孕前,应排除PHEO;若孕期检查发现已有PHEO病灶,应尽可能在妊娠期第3个月之前手术切除。(证据等级:D;推荐等级:C) 4.6 MEN2A病人HPTH的处理 推荐35:MEN2A病人一经确诊,应在行PHEO筛查的同时筛查HPTH。(证据等级:D;推荐等级:B) 推荐36:术中仅需切除肉眼可见的增生甲状旁腺,如果4个甲状旁腺均有增生,则可取一小块甲状旁腺腺体带血管蒂原位保留,其余旁腺切除;或者行全甲状旁腺切除术,将旁腺异位移植。(证据等级:D;推荐等级:B) 推荐37:MEN2A病人行甲状腺切除术后如果发现HPTH,再次手术之前,应进行增生旁腺的定位检查。再次手术时,应切除所有肉眼增生的甲状旁腺,并将正常大小的旁腺原位保留。若术中发现单个甲状旁腺增大,并且有病理学证据表明先前已切除了3个甲状旁腺腺体,则应将一部分腺体带血管蒂原位保留,或者将腺体切除后将其异位移植。(证据等级:D;推荐等级:B) 5 局部晚期不可手术及远处转移性MTC的临床治疗 5.1 局部晚期不可手术MTC的治疗 总体上MTC的侵袭性高于DTC,因此,临床上可以观察到更多MTC病人在初次就诊时原发灶或区域淋巴结即已进展至局部晚期,R0切除的机会极低,且需要付出多种器官功能丧失的代价。对于此类病人,传统的外科/放疗/化疗多学科治疗模式所能获得的疗效有限,预后较差。 近年来,随着靶向药物的发展,目前已有多种多靶点的小分子酪氨酸激酶抑制剂,被报道对不可切除的局部晚期MTC有效,包括凡德他尼、卡博替尼、乐伐替尼、安罗替尼、索凡替尼、阿西替尼等[28-32],其中凡德他尼和卡博替尼已被欧美批准用于局部晚期或远处转移性MTC的临床治疗。值得一提的是,以上临床试验均以总体的有效率、无病存活率或总存活率作为研究终点。那么应用靶向药物后,原局部晚期不可切除的病灶是否可降期为可手术病灶,或在原手术范围基础上提高器官保留率,当前的报道仍然缺乏,但类似的临床试验招募已在国内和欧美的各大癌症中心逐渐开始。 另一方面,亦有研究显示传统外放射治疗对部分局部晚期MTC有效,Rowell等[33]在对27个回顾性研究进行系统综述后发现,约有21%(13/63)的病人在接受外放疗后,局部病灶达到完全缓解,但该研究未涉及MTC的预后评估。 推荐38:对局部晚期不可手术的MTC病人可考虑参加相关临床试验,或行系统治疗。对于复发性髓样癌,也可考虑放疗,参见推荐53。(证据等级:C;推荐等级:B) 5.2 全身系统治疗 转移性MTC尚无法治愈,总体治疗目标是提高局部控制率、缓解全身症状与转移灶症状、减少疾病相关死亡。部分晚期病人疾病进展缓慢,因此,目前不推荐对无症状且无明确病灶的病人进行治疗。当出现明确病灶时,医生需要衡量肿瘤生长速度、生活质量与治疗毒性之间的关系,合理选择治疗方案。 5.2.1 靶向治疗 MTC具有众多基因突变,是系统治疗的潜在靶点。几乎所有MEN2和半数的散发性MTC病人中都存在体细胞RET突变。在RET野生型的病人中,18%~80%具有体细胞RAS突变。另外,血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)也在MTC肿瘤细胞中高表达[34]。众多酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)药物涵盖了MTC的治疗靶点,并在晚期MTC中进行了多项临床试验。然而,目前有Ⅲ期随机对照临床试验证据的靶向药物凡德他尼、卡博替尼均未在中国上市,部分有Ⅱ期临床试验证据的药物在MTC中的适应证也未获批。近期文献报道,MTC伴随大量免疫细胞浸润与免疫分子表达,其中PD-L1表达与肿瘤复发相关,提示免疫检查点抑制剂在晚期MTC中有潜在治疗价值[35]。 推荐39:影像学评估病灶稳定、肿瘤负荷小且血清Ctn和CEA倍增时间>2年的晚期MTC病人,不应给予系统治疗。(证据等级:C;推荐等级:B) 推荐40:进展性、晚期MTC病人首选加入设计良好的临床试验。(证据等级:D;推荐等级:C) 5.2.1.1 多靶点酪氨酸激酶抑制剂 凡德他尼是一个口服的小分子多靶点TKI,其主要作用靶点为RET、EGFR和VEGFR。基于一项前瞻性、随机双盲、对比凡德他尼和安慰剂治疗局部晚期或转移性MTC的Ⅲ期临床试验(ZETA)的结果,美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)于2011年批准凡德他尼用于治疗进展性、有症状的、不可手术的局部晚期或转移性MTC。 卡博替尼的主要治疗靶点为RET,MET和VEGFR2,也是一个口服的小分子多靶点TKI。基于一项前瞻性、随机双盲、对比卡博替尼和安慰剂治疗影像学进展的转移性MTC的Ⅲ期临床试验(EXAM)的结果[36]。目前已被FDA和EMA批准上市,用于治疗晚期转移性MTC。 盐酸安罗替尼是我国自主研发的多靶点TKI,主要作用于VEGFR2/3、成纤维细胞生长因子受体1-4(FGFR1-4)及血小板源生长因子受体(PDGFR)。在单臂、多中心的Ⅱ期的临床研究中,共有58例局部晚期或远处转移的MTC入组,56.9% 达到部分缓解。48周的PFS率为85.5%,45例病人的Ctn较基线下降>50%[31]。目前安罗替尼已向SFDA递交申请用于无法手术的局部晚期或转移性甲状腺髓样癌病人的治疗。 索拉非尼用于碘治疗抵抗的DTC的适应证已经在国内获批,其在晚期MTC中也有一定疗效[37]。日本的小样本Ⅱ期研究报道,索拉非尼治疗MTC的客观缓解率为25%,疾病控制率为75%,其安全性与既往报道一致[38]。 索凡替尼的作用靶点为VEGFR,FGFR-1以及集落刺激因子1受体(colony-stimulating factor-1 receptor,CSF1R)。在我国的多中心Ⅱ期临床研究中,纳入了27例MTC病人,客观缓解率为22.2%,中位PFS为11.1个月。 乐伐替尼在欧美国家已获批用于碘治疗抵抗的DTC,但在MTC中只有Ⅱ期临床研究的结果。在一项纳入58例晚期、进展性MTC的临床试验中,乐伐替尼的客观缓解率为36%,中位反应时间为3.5个月,中位PFS为9个月,疾病控制率达80%[30]。 5.2.1.2 高选择性RET抑制剂 RET是MTC的主要驱动基因,也是治疗MTC潜在最有效的靶点。高选择性的RET抑制剂与之前的多靶点TKI不同,其对RET的亲和力高,对于RET的融合突变及点突变均有效。目前已有两个小分子高选择性RET抑制剂,分别为BLU-667和LOXO-292,均在临床试验阶段。初步研究报道,两个药物对既往接受过TKI治疗、或TKI耐药的MTC也有一定疗效,不良反应可控[39-40]。其中LOXO-292因其在Ⅰ/Ⅱ期临床试验中表现出的良好疗效,已被美国FDA加速获批上市。 推荐41:靶向治疗是晚期远处转移性MTC的一线系统治疗方案。(证据等级:A;推荐等级:A) 5.2.2 化疗 单药或联合化疗治疗MTC的反应率较低,且维持时间较短。其中,最有效的方案是5-氟尿嘧啶和达卡巴嗪联合治疗,小规模病例报道中ORR为60%~75%,缓解时间约维持9个月[41]。另有阿霉素联合5-氟尿嘧啶、达卡巴嗪的化疗方案,在20例病人的队列中,3例部分缓解,10例病情稳定[42]。 5.2.3 放射性同位素治疗 应用放射性核素标记的分子治疗晚期MTC的经验有限。在一项应用[90Y-DOTA]-TOC治疗晚期MTC的Ⅱ期临床试验中,18例(58.1%)Ctn的倍增时间较前延长1倍,9例(29%)Ctn水平较前降低。Ctn水平降低者的中位生存期显著延长[43]。在核素显像阳性的病人中,应用131I-MIBG和111In-奥曲肽和177Lu-生长抑素类似物治疗可以使部分病人疾病稳定甚至缓解,可作为姑息治疗的选择[44-46]。由于缺乏高质量循证医学证据,目前仅推荐在设计良好的临床试验中利用放射性同位素治疗晚期MTC。 5.3 远处转移病灶的局部治疗 MTC病人较DTC更易出现远处转移,常见的转移部位包括肺、骨、脑、肝等,根据转移部位不同,可采取相应的局部治疗方式。 推荐42:MTC单发脑转移可进行手术切除或立体定向放射外科治疗;多发脑转移可进行全脑放疗。(证据等级:D;推荐等级:C) 推荐43:骨转移病人出现脊髓压迫症状可进行激素冲击治疗和手术减压。放疗可缓解骨转移导致的骨痛症状。(证据等级:D;推荐等级:C) 推荐44:骨转移病人可从双膦酸盐或地舒单抗的治疗中获益。(证据等级:D;推荐等级:B) 推荐45:局限性、有症状的肺及纵隔转移可考虑局部治疗;多发、进展性的肺及纵隔转移首选系统治疗。(证据等级:D;推荐等级:C) 推荐46:多发肝转移可行肝动脉栓塞化疗。(证据等级:C;推荐等级:B) 5.4 激素相关症状的治疗 5.4.1 腹泻 晚期MTC病人往往伴随腹泻,腹泻可影响病人的生活质量和营养状况,故腹泻严重者应予对症治疗。一般治疗包括禁酒、限制高纤维食物的摄入,如无改善,则考虑药物治疗。腹泻的一线治疗药物包括抗胃肠动力药物洛哌丁胺、阿托品及可待因,其副反应较小。 5.4.2 异位Cushing综合征 除Ctn外,MTC偶尔可分泌其他激素,如CRH或ACTH,导致异位Cushing综合征的发生。降低皮质醇的方法包括:治疗肝脏转移灶(手术或化疗栓塞)、药物治疗(酮康唑、米非司酮、氨基谷氨酰胺、甲吡酮或米托坦)、及双侧肾上腺切除术[47]。 推荐47:MTC病人合并Cushing综合征者预后差,应予积极治疗。治疗策略包括药物治疗及双侧肾上腺切除等。(证据等级:D;推荐等级:C) 6 MTC的随访监测 6.1 初次手术疗效及复发风险评估 MTC初次手术后,应对病人的手术治疗效果和复发转移风险进行评估,以便于制定进一步的治疗随访计划。MTC的预后主要与病人初次诊断时的肿瘤分期以及手术切除效果有关,另外,病人的年龄,基因突变位点,术后Ctn倍增时间等因素也与预后密切相关。 初次手术治疗效果是预后的关键因素,2013年Tuttle和 Ganly仿照DTC提出MTC的动态复发风险分层,将MTC初次术后的病人分为4类:(1)生化治愈。手术完整切除肿瘤,Ctn降至检测水平以下。(2)解剖治愈。肿瘤标记物(Ctn素和CEA)升高,但无影像学可见病灶。(3)解剖残留。持续存在的解剖残留或远处转移。(4)疾病状态不确定。非特异的影像学异常、生化异常、或无法检测的解剖残留。生化治愈的病人10年存活率为95%~97%[48],Ctn持续升高的病人5年和10年存活率分别为80%~86%和70%[49]。 推荐48:所有MTC病人均应进行终生随访,应根据基因突变,TNM分期,手术切除效果,术后Ctn及CEA水平以及倍增时间,确定随访内容和随访间隔。(证据等级:C;推荐等级:B) 6.2 Ctn和CEA倍增时间 对于MTC来说,无论是术前诊断还是术后判断复发转移,Ctn的灵敏度和特异度都是最高的。由于Ctn半衰期长,术后过早检测Ctn可能对手术疗效评估不准确,尤其是当病人存在肝肾基础疾病或术前Ctn水平较高的情况下[50]。一项研究提示,淋巴结转移程度不同的病人,术后Ctn降至正常范围的时间存在差异,伴有淋巴结转移且术前Ctn>1000 ng/L的病人,Ctn降至正常的平均时间为57.7 d[51]。 术后持续性Ctn升高并不一定提示肿瘤复发,但进行性升高的Ctn则与复发转移相关[52]。在一项包含65例病人的回顾性研究中,血清Ctn倍增时间<6个月的病人其5年和10年存活率分别为25%和8%,而倍增时间为6到24个月的病人其5年和10年存活率分别为92%和37%,倍增时间>24个月的病人在研究结束时均存活,且Ctn倍增时间是该研究多因素分析中惟一可作为独立预后因素的指标。对于MTC复发预测,CEA的特异度低于Ctn,在一项研究中,55例病人中,有80%Ctn和CEA倍增时间是一致的,因此,临床医生应当同时检测两项指标的倍增时间[53]。 推荐49:初次手术后3个月应检测Ctn及CEA水平,评估手术疗效,肿瘤标记物低于检测水平以下的病人,可随访观察,随访间隔可设为6~12个月。(证据等级:C;推荐等级:B) 推荐50:对于术后Ctn及CEA水平持续升高,或降至正常后再次升高的病人,应计算Ctn倍增时间,应至少连续检测4次,每次间隔至少6个月,病人随访间隔为3~6个月。(证据等级:C;推荐等级:B) 6.3 Ctn升高病人的影像学检查 推荐51:术后Ctn和CEA高于正常范围的病人应进行影像学检查积极寻找持续或复发病灶。初步的检查手段包括全身体格检查,颈部超声,颈胸部CT,腹部MRI,骨扫描,脊椎骨盆MRI,如仍未发现病灶,可进一步行18F-FDG,18F-DOPA和68Ga生长抑素受体为显像剂的PET-CT。(证据等级:C;推荐等级:C) 7 复发性MTC的治疗 7.1 二次手术 对于明确甲状腺局部或区域淋巴结残留/复发者,应考虑二次手术。淋巴结的清扫范围可涉及中央区、侧颈部及上纵隔淋巴结。约1/3的病人二次手术后Ctn可降至正常水平,且Ctn明显降低者后续发生远处转移的概率较小。但尚无前瞻性临床研究对比二次手术与观察随访的优劣。 对于术前未诊断出MTC,行单侧腺叶切除术后病理确诊为MTC的病人,建议详细追问病史,有条件的单位可进一步行基因检测,若怀疑为HMTC,则建议行补充性对侧腺叶切除术和预防性中央区淋巴结清扫。若考虑为散发性MTC,且无明显危险因素,则无需常规行补充性对侧腺叶切除术。 推荐52:对于仅有局部区域残留/复发,且可手术切除的病人应考虑二次手术。(证据等级:C;推荐等级:A) 7.2 放射治疗 目前尚无随机对照临床研究评价放疗在局部区域复发MTC中的价值。2019年的一篇Meta分析显示,单纯放疗治疗局部区域残留/复发髓样的完全缓解率为21%,部分缓解率为41%,且29%的病人5年无局部区域复发。二次手术后的辅助放疗处理原则可参考初始治疗,并基于外科医生和放疗科医生的个体化选择。总体来讲,放疗可以改善高危病人的肿瘤局部控制率,但无法改善总生存,放疗在低危病人中疗效有限[54]。 推荐53:对于无法手术的局部区域残留/复发病人,在权衡疗效和不良反应后,可考虑放疗。(证据等级:B;推荐等级:C) 8 总结与展望 基于RET基因突变位点的基因筛查对于HMTC的预防性干预和晚期MTC的个体化治疗具有重要意义,相关的遗传咨询和治疗策略在国内仍然有待发展。 MTC的诊断仍以病史询问、体格检查、影像学检查(彩超、CT、MRI)、实验室检查(Ctn、CEA)和FNA病理为主。在此基础上,核医学科检查的意义主要在于为生化复发的MTC病人寻找潜在复发病灶,诊断准确率的提升依赖于新型显像剂和检测模式的研究。 外科手术是MTC惟一的根治性治疗方式,手术指征近年来无明显变化,主要的争议集中于预防性颈部淋巴结清扫的指征和范围。此外,散发性和HMTC的手术范围略有不同。 散发性和HMTC均可伴有多种甲状腺外器官病变,包括肾上腺、甲状旁腺、激素异常分泌相关症状等,因此,完善的MTC治疗策略是一种综合治疗,建立在详细的全身评估基础上,需要在合适的治疗时机联合应用多种治疗手段。 局部晚期不可手术和远处转移性MTC是当前MTC治疗中的主要挑战,靶向治疗是其主要的治疗选择。多个药物已于欧美获批进入临床应用,但未在国内上市。对于此类病人均建议筛选参加相关的临床试验。 当前MTC靶向治疗模式主要有两个方向:(1)围绕免疫抑制靶点的联合用药方案。(2)针对局部晚期不可手术病人的新辅助治疗模式,前者已在其他肿瘤中有较多报道,且已具备丰富的机制研究基础,后者主要以临床试验的形式展开,值得期待。 声明:(1)本共识参考了2013年后国外现有的各大临床指南,在此基础上加入国内文献和证据。但对于部分内容,国内尚无相关报道或尚未临床普及,因此,使用时首先应从自身所在地区的实际情况出发,酌情进行参考。(2)实验室检查的检查方法和参考范围,各国各地区、各时间段均可存在差异,因此,本共识中的具体数值均为客观表述,以参考文献为准。使用时请根据实际情况进行转换,并且对比时尽量以同单位检查结果为参照。
 孟达理医生的科普号
孟达理医生的科普号 2021年12月27日
2021年12月27日 1354
1354
 0
0
 3
3
-
降钙素(CT)升高可能是什么病?
降钙素(CT)是甲状腺滤泡细胞C细胞合成和分泌的一种单链多肽激素,由32个氨基酸残基组成,分子量3500,它的生理作用主要是抑制破骨细胞的生成,促进骨盐沉积,增加尿磷,降低血钙和血磷。化验正常参考值
贾钰华医生的科普号 2021年08月28日
2021年08月28日 3534
3534
 0
0
 32
32
-
警惕少见的甲状腺恶性肿瘤--甲状腺髓样癌
随着大众对健康的关注与日俱增,甲状腺结节早已不再是陌生名词,并且很多人都听说过“甲状腺结节大多数是良性的,即使是恶性的也是最懒惰的肿瘤”这样的话,但是这句话只说对了一半,因为还有一小部分甲状腺癌并不那么温和。我们的患者老金(化名)遭遇的就是这样的一种甲状腺癌。去年10月,老金(化名)到上海某医院体检,发现双侧甲状腺多发结节,其中最大的结节直径大于2cm,因为平时不痛不痒毫无感觉,老金自己觉得应该没啥大事,但结节确实又比较大,经朋友推荐,就来到九院内分泌科就诊。门诊B超检查发现甲状腺双侧多发结节,但在那个最大的结节旁边有一个大小约5mm的小结节,呈垂直样生长,这高度提示恶性可能较大,因此建议患者行甲状腺结节细针穿刺活检,同时检测了血清甲状腺功能和降钙素水平。患者血清甲状腺功能正常,但是降钙素轻度升高,病理结果却是:甲状腺髓样癌不能排除。老金一时无法接受这个结果,经过医生的耐心开导,老金终于知道甲状腺髓样癌的恶性程度比乳头状癌高多了。为了得到确切的诊断,患者同意择期复查甲状腺结节穿刺活检。我们在第二次做细针穿刺的同时,留取了穿刺液检测降钙素浓度,同时检测了甲状腺髓样癌的致病基因—RET基因。这次的病理结果仍显示甲状腺髓样癌不能除外,但穿刺液降钙素提示大于2000pmol/L,基因检测提示存在RET基因突变。至此,老金明确诊断为甲状腺髓样癌。2周后,老金到普外科做了手术治疗,术后病理证实了我们之前的穿刺结果,考虑为甲状腺髓样癌,但幸运的是未见到颈部淋巴结和周围组织的转移。甲状腺髓样癌是继甲状腺乳头状癌、甲状腺滤泡腺癌的第三种甲状腺恶性肿瘤,据估计在甲状腺结节患者中占0.4%-1.4%,但恶性程度却高于常见的乳头状癌和滤泡腺癌。甲状腺髓样癌来源于滤泡旁细胞(C细胞),四分之一的病例发生在遗传性多发内分泌腺瘤的患者中。甲状腺髓样癌的10年疾病特异性死亡率为13.5-38%,其导致的死亡人数占所有甲状腺癌死亡总人数的13.4%。手术是目前治疗甲状腺髓样癌的唯一方法,而肿瘤的分期是预后的关键因素。局限在甲状腺内的髓样癌患者,10年生存率可达95.6%,而出现局部转移或远处转移的患者,10年生存率仅75.5%和40%,但由于髓样癌的超声图像缺乏典型特征,为早期诊断带来一定的困扰,很多患者在确诊时往往已经有淋巴结转移。降钙素是甲状腺髓样癌的重要标志物,在甲状腺结节的患者中筛查降钙素可提高甲状腺髓样癌的诊断效率,可以在髓样癌的早期阶段发现肿瘤。
韩兵医生的科普号 2021年08月11日
2021年08月11日 1617
1617
 0
0
 2
2
-
指南与共识|甲状腺髓样癌诊断与治疗中国专家共识(2020版)
甲状腺癌病人中,90%以上为分化型甲状腺癌(DTC),而甲状腺髓样癌(MTC)的发病率较低,且有其独特的临床病理特征,故而误诊、漏诊和不规范治疗现象仍然普遍存在。 MTC是起源于甲状腺滤泡旁细胞(C细胞)的恶性肿瘤。C细胞属于APUD系统,具有合成分泌降钙素(Ctn)及降钙素基因相关肽的作用,因此,MTC亦被认为是神经内分泌肿瘤之一。MTC在临床分型、诊断、治疗、随访及预后等多个方面与DTC均有所差异,故包括美国甲状腺协会(ATA)在内的多个机构都针对MTC制订了独立的临床诊治指南。为进一步提高我国MTC的诊治水平并提供更加合理及规范的诊治方案,中国医师协会外科医师分会甲状腺外科医师委员会、中国抗癌协会甲状腺癌专业委员会、中国研究型医院学会甲状腺疾病专业委员会结合近年来MTC领域的最新临床研究成果和国内实际的诊治现状,特制定本共识。一、MTC的分类及流行病学根据疾病的遗传特性,将MTC分为遗传性和散发性两大类。几乎所有的遗传性MTC(hereditary medullary thyroid cancer,HMTC)都伴有RET基因的胚系突变,50%的散发性MTC有RET基因的体细胞突变。散发性MTC发病率较高,占发病总数的75%~80%;遗传性MTC则多以多发性内分泌肿瘤综合征2型(MEN2)中的一部分发病,根据最新的ATA甲状腺髓样癌临床指南描述,可分为多发性内分泌腺瘤2A(MEN2A)和多发性内分泌腺瘤2B(MEN2B)。1.1 MEN2A约占所有MEN2病人的95%,又可分为4个亚型。1.1.1 经典型MEN2A最为常见,除了MTC外还可并发嗜铬细胞瘤和(或)甲状旁腺功能亢进(hyperparathyroidism,HPTH)。95%的病人RET基因突变在10号外显子的第609、611、618、620以及11号外显子的第634密码子。1.1.2 MEN2A伴皮肤苔藓淀粉样变(CLA)CLA的典型临床表现为脊柱T2-T6对应的背部肩胛区皮肤病损和瘙痒,几乎所有该类病人均携带RET基因第634密码子突变。1.1.3MEN2A伴先天性巨结肠(HD)约占MEN2A的7%,一般由于RET基因10号外显子突变所致。1.1.4 家族非多发性内分泌肿瘤性MTC(FMTC)即携带RET基因胚系突变但不合并嗜铬细胞瘤或HPTH的FMTC。1.2 MEN2B以MTC并发黏膜多发性神经瘤为特点,50%的病人还可伴有肾上腺嗜铬细胞瘤(pheochromocytoma,PHEO),一般不伴有HPTH。除此之外大部分病人还可表现为Marfan征外貌、眼部异常、骨骼畸形、消化道梗阻及其他临床表现。该类型恶性程度最高,早期即可发生淋巴结甚至远处转移。95%的MEN2B病人携带RET基因第16号外显子M918T突变,不足5%的病人携带15号外显子A883F突变。二、RET基因筛查遗传咨询及干预时机2.1 RET基因筛查和遗传咨询临床上1%~7%的散发性MTC病人实际具有遗传性MTC的基因背景,因此,散发性病例行基因筛查可进一步明确疾病分型。对于MTC基因筛查的目的主要有两方面:(1)在家系成员中排查特定种类的遗传性MTC。(2)根据不同的突变位点进行危险分层,以期有针对性地制定治疗策略。对于遗传性MTC病人,应常规告知病人,遗传性RET突变可能给家庭成员带来的风险,育龄的RET突变携带者,尤其是MEN2B型,建议进行孕前或产前的遗传咨询。推荐1:对于以下人群可推荐进行RET基因筛查和遗传咨询:(1)散发性MTC病人本人。(2)遗传性MTC病人本人及一级亲属。(3)在儿童或婴儿期出现MEN2B表现病人的父母。(4)皮肤苔藓淀粉样变的病人。(5)先天性巨结肠病病人,携带RET基因10号外显子突变。(证据等级:D;推荐等级:B)推荐2:进行RET基因筛查的具体目标位点包括:(1)MEN2A的基因筛查。需要检查的RET基因突变位点主要包括10号外显子的第609、611、618、620密码子、11号外显子的第630、634密码子。若上述检查未发现明确的突变位点,或临床表型与检查结果不一致时,应进一步采用RET基因编码区全测序进行筛查。(2)MEN2B的基因筛查:需要检查的RET基因突变位点主要包括16号外显子的M918T突变和15号外显子的A883F突变,若结果为阴性则行需要RET基因编码区全测序。(证据等级:D;推荐等级:A)推荐3:除计划使用选择性RET抑制剂治疗晚期MTC外,不常规筛查MTC病人的体系RET突变。(证据等级:D;推荐等级:B)推荐4:在十分罕见的家系中,会出现受检者符合MEN2A或MEN2B临床诊断标准,但整个RET编码区均没有基因突变的情况。这种情况下有风险的亲属应当采用传统的筛查MTC、嗜铬细胞瘤以及HPTH的方法来进行阶段性检查。(证据等级:D;推荐等级:B)2.2 基于RET突变位点的危险度分层目前发现与遗传性MTC有关的RET基因突变、插入、缺失位点>100个,而导致肿瘤发病的常为单点突变,少见双点甚至多点突变。不同类型的MTC对应不同的RET基因突变位点,不同的突变位点所致肿瘤的恶性程度亦不相同。推荐5:对于遗传性MTC根据不同的突变位点进行风险分层。可分为3级:(1)最高风险(HST)。包括MEN2B病人和RET密码子M918T突变。(2)高风险(H)。包括RET密码子C634突变和A883F突变。(3)中等风险(MOD)。包括遗传性MTC病人中除M918T、C634、A883F突变之外的病人。(证据等级:D;推荐等级:B)2.3 遗传性MTC的干预时机2.3.1 MEN2A儿童遗传性MTC的预防性甲状腺切除高风险类别儿童通常在出生后几年就发展为MTC,因此,应从3岁开始每年进行查体、颈部超声和血清Ctn水平检查。中风险类别的儿童通常稍年长时发展出侵袭性较低的MTC,因此,建议中风险类别儿童从5岁起每年进行体检,行颈部超声和Ctn检查。高风险类别儿童应在5岁之前进行甲状腺切除术,并根据Ctn水平指导手术时间和范围。中风险类别的儿童应在儿童期或成年期进行甲状腺切除术,手术时间主要取决于Ctn水平。一项纳入14例MEN2A患儿的回顾性研究表明,即使患儿已出现微小(≤1 cm)的MTC病灶,预防性全甲状腺切除术一般已足够安全可靠。2.3.2 MEN2B儿童遗传性MTC的预防性甲状腺切除对于MEN2B和携带RET密码子M918T突变的极高风险病人,应尽早行甲状腺切除术。最近的一项纳入345例MEN2B病人的全球多中心回顾性研究显示,在1岁以前行甲状腺切除术能够显著降低复发风险。因此,极高危类别婴儿出生后应立即进行基因检测,具体干预时间由外科医生或儿科医生与患儿父母沟通决定。推荐6:MEN2A/B患儿在充分评估手术获益与并发症风险的基础上,可考虑早期手术干预。具体治疗措施应与患儿监护人充分沟通。(证据等级:C;推荐等级:C)推荐7:极高风险类别中具有RET密码子M918T突变的患儿,推荐干预时间为出生的第一年内进行甲状腺切除术。术者应与患儿监护人协商,决定行甲状腺切除术的时机。开展首例手术时,应获得所在医院伦理委员会审批通过。(证据等级:C;推荐等级:C)推荐8:高风险类患儿推荐干预时间为5岁或更早时行甲状腺切除术,具体时机取决于是否发现肿瘤形成及血清Ctn升高的水平。(证据等级:C;推荐等级:B)推荐9:中风险类别的患儿推荐从5岁开始进行体格检查,颈部超声和血清Ctn水平检测。行甲状腺切除术的时机应取决于是否发现肿瘤形成及血清Ctn升高的水平。(证据等级:C;推荐等级:B)注:以上与预防性手术的相关推荐,因国内文献极少,主要参考国外MTC指南。考虑中国实际国情,国内缺乏相关经验,亦缺乏相关的法律条文指引,建议在与患儿监护人充分沟通后方可参考。三、MTC的初始诊断评估3.1 MTC的生物标记物检测Ctn是一类多肽类激素,主要由甲状腺滤泡旁C细胞表达并分泌释放,故在MTC病人中特征性地表达。多个大样本前瞻性非随机对照研究证实,对甲状腺结节病人常规筛查血清Ctn能提高MTC的检出率及总体存活率。我国学者的一项大型回顾性研究显示血清Ctn对于诊断MTC的灵敏度、特异度均较高,同时其检测费用相对较低。我国于2017年发布的《甲状腺癌血清标志物临床应用专家共识》推荐对于怀疑恶性的甲状腺肿瘤病人,术前应常规行血清Ctn检测。考虑检测方法的差别及更新,血清Ctn尚无统一的参考范围。2015年ATA颁布的MTC诊治指南建议各诊疗单位可根据大样本对比研究确定各自的参考值范围,并强调对于同一病人病情判断,应采用与基线一致的检测方法(注:考虑到不同文献报道中Ctn的检测方法与参考范围亦存在差异,因此本共识中所有提及的Ctn具体数值均以相关的参考文献为准)。Ctn在肝脏和肾脏中代谢,其表达水平主要受血钙浓度的调节。须注意的是,血清Ctn水平可以受生理作用、病理作用、药理作用等多方面因素的影响。另外,对于肿瘤负荷较大,而血清Ctn阴性的病人,须注意免疫分析法的“脱钩现象”导致的假阴性可能。推荐10:对于怀疑恶性的甲状腺肿瘤病人,术前可考虑常规检测血清Ctn以对MTC进行筛查。(证据等级:C;推荐等级:A)推荐11:由于各大中心采用的检测方法不同,在对同一MTC病人进行血清Ctn监测时,建议采用与基线相同的检测方法。(证据等级:C;推荐等级:B)推荐12:国人对于预防性甲状腺手术接受率低,基因筛查普及率低。因此,对HMTC 家系突变基因携带者需采取密切影像学及血清Ctn变化随访。(证据等级:C;推荐等级:B)推荐13:术前血清Ctn的升高水平与MTC病人体内肿瘤负荷相关,结合影像学检查有助于评估病情及制定治疗决策。(证据等级:C;推荐等级:C)3.1.2 癌胚抗原除Ctn外,C细胞也能分泌癌胚抗原(carcinoembryonic antigen,CEA),因此,MTC病人的CEA水平也可能升高。尽管CEA的特异性不强,无法作为一个理想的MTC筛查指标,但一经诊断为MTC,仍建议同时检测血清Ctn和CEA浓度作为诊断和随访指标。部分MTC病人可表现为血清Ctn和CEA均低表达(非分泌型MTC)。一项纳入839例散发型MTC病人的研究中,非分泌型MTC病人占0.83%。该类病人肿瘤分化差、Ki-67较高、M918T突变更多见。推荐14:对于MTC诊断明确的病人,建议在术前同时检测血清Ctn和CEA水平。以CEA升高为首发症状就诊的病人,在排除消化道肿瘤后,建议补充Ctn及颈部超声检查。(证据等级:C;推荐等级:A)推荐15:CEA升高程度与肿瘤外侵、淋巴结转移和远处转移呈正相关,可与 Ctn一起用于评估疾病风险。(证据等级:C;推荐等级:B)推荐16:CEA升高与MTC肿瘤去分化相关,可作为根治术后监测肿瘤进展指标。(证据等级:C;推荐等级:B)3.2 辅助检查3.2.1 颈部超声检查超声检查是评估甲状腺恶性肿瘤最重要的影像学手段,首选用于甲状腺结节和颈部淋巴结的定性诊断。超声下MTC和转移性颈淋巴结的声像图特征大多和DTC类似。尽管超声检查与操作者的经验密切相关,但与增强CT相比,超声检查的敏感度、特异度和准确率均高于增强CT。推荐17:建议对所有的MTC可疑病人进行全面的病史收集、体格检查和颈部超声检查。(证据等级:C;推荐等级:A)3.2.2 MTC的细针穿刺活检B超引导下细针穿刺活检(fine needle aspiration,FNA)是重要的术前病理学诊断手段。国内外相关指南中,甲状腺结节的穿刺指征类似,可参考我国发布的《超声引导下甲状腺结节细针穿刺活检专家共识及操作指南(2018 版)》。在此基础上,若出现血清Ctn/CEA水平异常升高,穿刺指针可更加积极。穿刺冲洗液的Ctn检测以及免疫组化染色有助于提高MTC的确诊率。推荐18:在现有各大指南针对甲状腺结节的穿刺指征基础上,当出现CEA、Ctn升高时,细胞学检查应更为积极。(证据等级:C;推荐等级:C)3.2.3 RET突变检测MTC病人中RET基因突变最为常见,且不同突变位点对应不同的临床行为和预后特点。前文已述,可根据RET基因突变位点的不同,对HMTC进行基因筛选、遗传咨询并据此确立早期干预策略(详见“分子检测与遗传咨询”部分)。而对于散发性MTC,目前已有观点认为,基于不同突变位点的危险分层体系在将来同样可应用于散发性MTC的精细化诊治,但现阶段证据仍然不足。高选择性RET抑制剂的出现,显然将加速该观点的推进。推荐19:RET基因检测对散发型MTC病人危险分层以指导诊治具有重要价值。可以结合病人个体化需求及操作可行性,实施MTC基因分型检测。(证据等级:C;推荐等级:C)3.2.4 其他辅助检查多数研究者及指南认为应在术前对MTC病人进行系统性的影像学评估。CT对颈部、纵隔淋巴结病变及肺转移灶敏感[20]。MRI对判断肝脏转移灶更为有效,同时轴位MRI和骨显像是最常用且最敏感的骨转移评估方法。核医学显像方面,99mTc-MDP骨显像可用于骨转移灶的排查。另外,18F-FDG PET-CT和18F-DOPA也可用于MTC转移灶的评估,但由于检测灵敏度较低且价格昂贵,ATA指南不推荐两者作为远处转移的常规检查手段。但当血清Ctn升高或血清Ctn倍增时间缩短时,18F-FDG、18F-DOPA和68Ga-生长抑素受体显像可考虑用于评估MTC病人的复发/转移。除评估肿瘤累及范围外,还须仔细检查MTC病人是否合并PHEO和HPTH,尤其是对HMTC病人,避免手术麻醉风险。推荐20:MTC病人术前须接受系统性的影像学评估,明确肿瘤累及范围,为后续治疗提供客观依据。(证据等级:C;推荐等级:B)推荐21:PET-CT对术前分期的作用有限,当血清Ctn浓度较高或血清Ctn倍增时间较快时,18F-FDG、18F-DOPA和68Ga-生长抑素受体显像可用于评估MTC病人的复发/转移。(证据等级:C;推荐等级:C)推荐22:对于确诊MTC者,应常规筛查是否合并肾上腺嗜铬细胞瘤和甲状旁腺功能亢进症。(证据等级:C;推荐等级:B)四、初治可手术MTC的临床治疗4.1 MTC的外科治疗手术是目前首选且惟一被证明可以治愈MTC的方法,传统的放化疗则对本病疗效不佳。针对DTC的放射性碘治疗同样不适用于本病病人。对于合并甲状腺外病变的病人,相关治疗应同步进行。4.1.1 原发灶手术治疗目前国内外对HMTC的原发灶治疗的意见趋于统一。即无论是否存在远处转移病灶,对于原发灶可手术的病人,全甲状腺切除术均应作为初始的手术治疗方式。而对于散发性MTC病人,由于其较高的多灶和双侧发病概率,主流意见仍推荐将全甲状腺切除作为初始的手术治疗方式。少部分中心认为对于术前彩超及影像学检查仅考虑单侧且病灶较小的散发性病人,可考虑行患侧腺叶加峡部切除术。针对此种意见,目前尚缺少足够的循证医学证据,需要大样本临床研究数据支持。推荐23:对于基因检测已明确或有明确家族史的HMTC,无论肿瘤大小,单侧还是双侧病灶,均应行全甲状腺切除术。(证据等级:C;推荐等级:A)推荐24:对于基因检测已明确的散发性MTC,可行全甲状腺切除术;此类病人若病灶局限于单侧甲状腺,且无其他危险因素时可行腺叶切除术全甲状腺切除术。(证据等级:D;推荐等级:B)推荐25:对于未行基因检测、无明确家族史的MTC,建议行全甲状腺切除术。(证据等级:C;推荐等级:C)4.1.2 颈部淋巴结转移灶手术治疗4.1.2.1 中央区淋巴结清扫的指征无论是散发性或HMTC,cN1a病人均应行治疗性中央区淋巴结清扫。对于cN0病人,目前国外各大指南均推荐在全甲状腺切除的基础上行双侧预防性中央区清扫术(prophylactic central neck dissection,PCND)。这一结论基于:(1)无论肿瘤大小,MTC的中央区淋巴结转移发生率均较高(50%~75%)。(2)术前和术中对于中央区淋巴结评估的准确率并不令人满意[23]。(3)回顾性研究显示PCND有助于改善病人预后。4.1.2.2 侧颈淋巴结清扫的指征对于所有MTC病人,cN1b均提示须行治疗性侧颈淋巴结清扫,而对于cN0病人的预防性侧颈清扫,则仍存在争议。有研究表明,侧颈淋巴结转移率与颈中央区淋巴结转移数量密切相关,≥4枚中央区淋巴结转移时,同侧侧颈淋巴结转移率最高可达到98%。术前基础血清Ctn水平也可部分反应淋巴结转移程度。推荐26:cN0的MTC病人建议行预防性中央区淋巴结清扫。(证据等级:C;推荐等级:A)推荐27:大多数cN0的MTC病人无须行预防性侧颈淋巴结清扫,但仍须结合中央区淋巴结转移情况、血清Ctn水平和原发灶负荷等因素综合考虑。(证据等级:C;推荐等级:D)推荐28:(1)对于术前淋巴结分期为cN1a的MTC病人,应行中央区淋巴结清扫。(2)对于术前淋巴结分期为cN1b的MTC病人,应行侧颈区和中央区淋巴结清扫。(证据等级:C;推荐等级:A)4.1.2.3 上纵隔淋巴结清扫推荐29:对于中央区淋巴结较大或较多者建议行选择性上纵隔清扫,对于有明确的上纵隔淋巴结转移证据的病人,须根据临床特征进行区别处理。(证据等级:C;推荐等级:B)4.2 MTC的外放射治疗MTC局部复发的危险因素主要包括甲状腺外侵犯、术后病灶残留、临床分期晚、淋巴结阳性和纵隔受侵。当初始手术治疗无法达到根治目的时,可以考虑应用外放射疗法(EBRT)进行治疗以提高局部控制率。但目前尚无令人信服的证据证明术后EBRT对 MTC病人的总存活率的影响。与此同时,适当的EBRT可应用于转移性MTC的姑息治疗,例如疼痛性骨转移、纵隔或肺部转移引起的呼吸困难或咯血症状、保护颈部重要结构等。推荐30:当病人局部复发风险较高时,可考虑对颈部和(或)纵隔区进行外照射放疗。做出EBRT治疗决策前,应综合考虑治疗带来的获益和副反应。(证据等级:C;推荐等级:C)4.3 术后激素替代治疗全甲状腺切除术后病人应常规给予甲状腺素替代治疗。由于滤泡旁细胞肿瘤不依赖促甲状腺激素,并且没有证据显示TSH抑制疗法可降低MTC病人术后的复发率或提高存活率,所以MTC行全甲状腺切除术后无须对TSH水平进行过度抑制。推荐31:术后采用左旋甲状腺素行甲状腺功能的替代治疗,仅当合并DTC时,按照DTC风险分层进行TSH抑制处理。(证据等级:C;推荐等级:C)4.4 术后放射性碘治疗MTC病灶并不摄碘,有研究认为术后131I可以通过摄碘的甲状腺组织对MTC细胞达到间接辐射作用,或通过消除残余的甲状腺组织来达到减少复发的目的,但近期研究显示MTC病人的术后131I治疗并未降低其疾病特异性死亡风险,不推荐MTC病人行术后131I治疗。然而,对于MTC同时伴有DTC的病人,应结合其DTC部分的临床病理特征决定是否使用131I治疗。推荐32:对于不伴有DTC的MTC,不推荐行131I同位素治疗。(证据等级:C;推荐等级:B)4.5 伴有PHEO的MEN2A和MEN2B病人的治疗推荐33:MEN2病人一经确诊,建议尽早行PHEO的筛查,筛查方法可包括血浆肾上腺素和去甲肾上腺素检测,24 h尿儿茶酚胺检测,以及肾上腺CT和(或)MRI等。(证据等级:C;推荐等级:C)推荐34:MEN2A和MEN2B病人在行任何手术之前,均应行相关检查排除PHEO。女性病人备孕前,应排除PHEO;若孕期检查发现已有PHEO病灶,应尽可能在妊娠期第3个月之前手术切除。(证据等级:D;推荐等级:C)4.6 MEN2A病人HPTH的处理推荐35:MEN2A病人一经确诊,应在行PHEO筛查的同时筛查HPTH。(证据等级:D;推荐等级:B)推荐36:术中仅需切除肉眼可见的增生甲状旁腺,如果4个甲状旁腺均有增生,则可取一小块甲状旁腺腺体带血管蒂原位保留,其余旁腺切除;或者行全甲状旁腺切除术,将旁腺异位移植。(证据等级:D;推荐等级:B)推荐37:MEN2A病人行甲状腺切除术后如果发现HPTH,再次手术之前,应进行增生旁腺的定位检查。再次手术时,应切除所有肉眼增生的甲状旁腺,并将正常大小的旁腺原位保留。若术中发现单个甲状旁腺增大,并且有病理学证据表明先前已切除了3个甲状旁腺腺体,则应将一部分腺体带血管蒂原位保留,或者将腺体切除后将其异位移植。(证据等级:D;推荐等级:B)五、局部晚期不可手术及远处转移性MTC的临床治疗5.1 局部晚期不可手术MTC的治疗总体上MTC的侵袭性高于DTC,因此,临床上可以观察到更多MTC病人在初次就诊时原发灶或区域淋巴结即已进展至局部晚期,R0切除的机会极低,且需要付出多种器官功能丧失的代价。对于此类病人,传统的外科/放疗/化疗多学科治疗模式所能获得的疗效有限,预后较差。近年来,随着靶向药物的发展,目前已有多种多靶点的小分子酪氨酸激酶抑制剂,被报道对不可切除的局部晚期MTC有效,包括凡德他尼、卡博替尼、乐伐替尼、安罗替尼、索凡替尼、阿西替尼等,其中凡德他尼和卡博替尼已被欧美批准用于局部晚期或远处转移性MTC的临床治疗。值得一提的是,以上临床试验均以总体的有效率、无病存活率或总存活率作为研究终点。那么应用靶向药物后,原局部晚期不可切除的病灶是否可降期为可手术病灶,或在原手术范围基础上提高器官保留率,当前的报道仍然缺乏,但类似的临床试验招募已在国内和欧美的各大癌症中心逐渐开始。另一方面,亦有研究显示传统外放射治疗对部分局部晚期MTC有效,Rowell等在对27个回顾性研究进行系统综述后发现,约有21%(13/63)的病人在接受外放疗后,局部病灶达到完全缓解,但该研究未涉及MTC的预后评估。推荐38:对局部晚期不可手术的MTC病人可考虑参加相关临床试验,或行系统治疗。对于复发性髓样癌,也可考虑放疗,参见推荐53。(证据等级:C;推荐等级:B)5.2 全身系统治疗转移性MTC尚无法治愈,总体治疗目标是提高局部控制率、缓解全身症状与转移灶症状、减少疾病相关死亡。部分晚期病人疾病进展缓慢,因此,目前不推荐对无症状且无明确病灶的病人进行治疗。当出现明确病灶时,医生需要衡量肿瘤生长速度、生活质量与治疗毒性之间的关系,合理选择治疗方案。5.2.1 靶向治疗MTC具有众多基因突变,是系统治疗的潜在靶点。几乎所有MEN2和半数的散发性MTC病人中都存在体细胞RET突变。在RET野生型的病人中,18%~80%具有体细胞RAS突变。另外,血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)也在MTC肿瘤细胞中高表达。众多酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)药物涵盖了MTC的治疗靶点,并在晚期MTC中进行了多项临床试验。然而,目前有Ⅲ期随机对照临床试验证据的靶向药物凡德他尼、卡博替尼均未在中国上市,部分有Ⅱ期临床试验证据的药物在MTC中的适应证也未获批。近期文献报道,MTC伴随大量免疫细胞浸润与免疫分子表达,其中PD-L1表达与肿瘤复发相关,提示免疫检查点抑制剂在晚期MTC中有潜在治疗价值。推荐39:影像学评估病灶稳定、肿瘤负荷小且血清Ctn和CEA倍增时间>2年的晚期MTC病人,不应给予系统治疗。(证据等级:C;推荐等级:B)推荐40:进展性、晚期MTC病人首选加入设计良好的临床试验。(证据等级:D;推荐等级:C)5.2.1.1 多靶点酪氨酸激酶抑制剂凡德他尼是一个口服的小分子多靶点TKI,其主要作用靶点为RET、EGFR和VEGFR。基于一项前瞻性、随机双盲、对比凡德他尼和安慰剂治疗局部晚期或转移性MTC的Ⅲ期临床试验(ZETA)的结果,美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)于2011年批准凡德他尼用于治疗进展性、有症状的、不可手术的局部晚期或转移性MTC。卡博替尼的主要治疗靶点为RET,MET和VEGFR2,也是一个口服的小分子多靶点TKI。基于一项前瞻性、随机双盲、对比卡博替尼和安慰剂治疗影像学进展的转移性MTC的Ⅲ期临床试验(EXAM)的结果[36]。目前已被FDA和EMA批准上市,用于治疗晚期转移性MTC。盐酸安罗替尼是我国自主研发的多靶点TKI,主要作用于VEGFR2/3、成纤维细胞生长因子受体1-4(FGFR1-4)及血小板源生长因子受体(PDGFR)。在单臂、多中心的Ⅱ期的临床研究中,共有58例局部晚期或远处转移的MTC入组,56.9% 达到部分缓解。48周的PFS率为85.5%,45例病人的Ctn较基线下降>50%。目前安罗替尼已向SFDA递交申请用于无法手术的局部晚期或转移性甲状腺髓样癌病人的治疗。索拉非尼用于碘治疗抵抗的DTC的适应证已经在国内获批,其在晚期MTC中也有一定疗效。日本的小样本Ⅱ期研究报道,索拉非尼治疗MTC的客观缓解率为25%,疾病控制率为75%,其安全性与既往报道一致。索凡替尼的作用靶点为VEGFR,FGFR-1以及集落刺激因子1受体(colony-stimulating factor-1 receptor,CSF1R)。在我国的多中心Ⅱ期临床研究中,纳入了27例MTC病人,客观缓解率为22.2%,中位PFS为11.1个月。乐伐替尼在欧美国家已获批用于碘治疗抵抗的DTC,但在MTC中只有Ⅱ期临床研究的结果。在一项纳入58例晚期、进展性MTC的临床试验中,乐伐替尼的客观缓解率为36%,中位反应时间为3.5个月,中位PFS为9个月,疾病控制率达80%。5.2.1.2 高选择性RET抑制剂RET是MTC的主要驱动基因,也是治疗MTC潜在最有效的靶点。高选择性的RET抑制剂与之前的多靶点TKI不同,其对RET的亲和力高,对于RET的融合突变及点突变均有效。目前已有两个小分子高选择性RET抑制剂,分别为BLU-667和LOXO-292,均在临床试验阶段。初步研究报道,两个药物对既往接受过TKI治疗、或TKI耐药的MTC也有一定疗效,不良反应可控。其中LOXO-292因其在Ⅰ/Ⅱ期临床试验中表现出的良好疗效,已被美国FDA加速获批上市。推荐41:靶向治疗是晚期远处转移性MTC的一线系统治疗方案。(证据等级:A;推荐等级:A)5.2.2 化疗单药或联合化疗治疗MTC的反应率较低,且维持时间较短。其中,最有效的方案是5-氟尿嘧啶和达卡巴嗪联合治疗,小规模病例报道中ORR为60%~75%,缓解时间约维持9个月。另有阿霉素联合5-氟尿嘧啶、达卡巴嗪的化疗方案,在20例病人的队列中,3例部分缓解,10例病情稳定。5.2.3 放射性同位素治疗应用放射性核素标记的分子治疗晚期MTC的经验有限。在一项应用[90Y-DOTA]-TOC治疗晚期MTC的Ⅱ期临床试验中,18例(58.1%)Ctn的倍增时间较前延长1倍,9例(29%)Ctn水平较前降低。Ctn水平降低者的中位生存期显著延长。在核素显像阳性的病人中,应用131I-MIBG和111In-奥曲肽和177Lu-生长抑素类似物治疗可以使部分病人疾病稳定甚至缓解,可作为姑息治疗的选择。由于缺乏高质量循证医学证据,目前仅推荐在设计良好的临床试验中利用放射性同位素治疗晚期MTC。5.3 远处转移病灶的局部治疗MTC病人较DTC更易出现远处转移,常见的转移部位包括肺、骨、脑、肝等,根据转移部位不同,可采取相应的局部治疗方式。推荐42:MTC单发脑转移可进行手术切除或立体定向放射外科治疗;多发脑转移可进行全脑放疗。(证据等级:D;推荐等级:C)推荐43:骨转移病人出现脊髓压迫症状可进行激素冲击治疗和手术减压。放疗可缓解骨转移导致的骨痛症状。(证据等级:D;推荐等级:C)推荐44:骨转移病人可从双膦酸盐或地舒单抗的治疗中获益。(证据等级:D;推荐等级:B)推荐45:局限性、有症状的肺及纵隔转移可考虑局部治疗;多发、进展性的肺及纵隔转移首选系统治疗。(证据等级:D;推荐等级:C)推荐46:多发肝转移可行肝动脉栓塞化疗。(证据等级:C;推荐等级:B)5.4 激素相关症状的治疗5.4.1 腹泻晚期MTC病人往往伴随腹泻,腹泻可影响病人的生活质量和营养状况,故腹泻严重者应予对症治疗。一般治疗包括禁酒、限制高纤维食物的摄入,如无改善,则考虑药物治疗。腹泻的一线治疗药物包括抗胃肠动力药物洛哌丁胺、阿托品及可待因,其副反应较小。5.4.2 异位Cushing综合征除Ctn外,MTC偶尔可分泌其他激素,如CRH或ACTH,导致异位Cushing综合征的发生。降低皮质醇的方法包括:治疗肝脏转移灶(手术或化疗栓塞)、药物治疗(酮康唑、米非司酮、氨基谷氨酰胺、甲吡酮或米托坦)、及双侧肾上腺切除术。推荐47:MTC病人合并Cushing综合征者预后差,应予积极治疗。治疗策略包括药物治疗及双侧肾上腺切除等。(证据等级:D;推荐等级:C)六、MTC的随访监测6.1 初次手术疗效及复发风险评估MTC初次手术后,应对病人的手术治疗效果和复发转移风险进行评估,以便于制定进一步的治疗随访计划。MTC的预后主要与病人初次诊断时的肿瘤分期以及手术切除效果有关,另外,病人的年龄,基因突变位点,术后Ctn倍增时间等因素也与预后密切相关。初次手术治疗效果是预后的关键因素,2013年Tuttle和 Ganly仿照DTC提出MTC的动态复发风险分层,将MTC初次术后的病人分为4类:(1)生化治愈。手术完整切除肿瘤,Ctn降至检测水平以下。(2)解剖治愈。肿瘤标记物(Ctn素和CEA)升高,但无影像学可见病灶。(3)解剖残留。持续存在的解剖残留或远处转移。(4)疾病状态不确定。非特异的影像学异常、生化异常、或无法检测的解剖残留。生化治愈的病人10年存活率为95%~97%,Ctn持续升高的病人5年和10年存活率分别为80%~86%和70%。推荐48:所有MTC病人均应进行终生随访,应根据基因突变,TNM分期,手术切除效果,术后Ctn及CEA水平以及倍增时间,确定随访内容和随访间隔。(证据等级:C;推荐等级:B)6.2 Ctn和CEA倍增时间对于MTC来说,无论是术前诊断还是术后判断复发转移,Ctn的灵敏度和特异度都是最高的。由于Ctn半衰期长,术后过早检测Ctn可能对手术疗效评估不准确,尤其是当病人存在肝肾基础疾病或术前Ctn水平较高的情况下。一项研究提示,淋巴结转移程度不同的病人,术后Ctn降至正常范围的时间存在差异,伴有淋巴结转移且术前Ctn>1000 ng/L的病人,Ctn降至正常的平均时间为57.7d。术后持续性Ctn升高并不一定提示肿瘤复发,但进行性升高的Ctn则与复发转移相关。在一项包含65例病人的回顾性研究中,血清Ctn倍增时间<6个月的病人其5年和10年存活率分别为25%和8%,而倍增时间为6到24个月的病人其5年和10年存活率分别为92%和37%,倍增时间>24个月的病人在研究结束时均存活,且Ctn倍增时间是该研究多因素分析中惟一可作为独立预后因素的指标。对于MTC复发预测,CEA的特异度低于Ctn,在一项研究中,55例病人中,有80%Ctn和CEA倍增时间是一致的,因此,临床医生应当同时检测两项指标的倍增时间。推荐49:初次手术后3个月应检测Ctn及CEA水平,评估手术疗效,肿瘤标记物低于检测水平以下的病人,可随访观察,随访间隔可设为6~12个月。(证据等级:C;推荐等级:B)推荐50:对于术后Ctn及CEA水平持续升高,或降至正常后再次升高的病人,应计算Ctn倍增时间,应至少连续检测4次,每次间隔至少6个月,病人随访间隔为3~6个月。(证据等级:C;推荐等级:B)6.3 Ctn升高病人的影像学检查推荐51:术后Ctn和CEA高于正常范围的病人应进行影像学检查积极寻找持续或复发病灶。初步的检查手段包括全身体格检查,颈部超声,颈胸部CT,腹部MRI,骨扫描,脊椎骨盆MRI,如仍未发现病灶,可进一步行18F-FDG,18F-DOPA和68Ga生长抑素受体为显像剂的PET-CT。(证据等级:C;推荐等级:C)七、复发性MTC的治疗7.1 二次手术对于明确甲状腺局部或区域淋巴结残留/复发者,应考虑二次手术。淋巴结的清扫范围可涉及中央区、侧颈部及上纵隔淋巴结。约1/3的病人二次手术后Ctn可降至正常水平,且Ctn明显降低者后续发生远处转移的概率较小。但尚无前瞻性临床研究对比二次手术与观察随访的优劣。对于术前未诊断出MTC,行单侧腺叶切除术后病理确诊为MTC的病人,建议详细追问病史,有条件的单位可进一步行基因检测,若怀疑为HMTC,则建议行补充性对侧腺叶切除术和预防性中央区淋巴结清扫。若考虑为散发性MTC,且无明显危险因素,则无需常规行补充性对侧腺叶切除术。推荐52:对于仅有局部区域残留/复发,且可手术切除的病人应考虑二次手术。(证据等级:C;推荐等级:A)7.2 放射治疗目前尚无随机对照临床研究评价放疗在局部区域复发MTC中的价值。2019年的一篇Meta分析显示,单纯放疗治疗局部区域残留/复发髓样的完全缓解率为21%,部分缓解率为41%,且29%的病人5年无局部区域复发。二次手术后的辅助放疗处理原则可参考初始治疗,并基于外科医生和放疗科医生的个体化选择。总体来讲,放疗可以改善高危病人的肿瘤局部控制率,但无法改善总生存,放疗在低危病人中疗效有限。推荐53:对于无法手术的局部区域残留/复发病人,在权衡疗效和不良反应后,可考虑放疗。(证据等级:B;推荐等级:C)八、总结与展望基于RET基因突变位点的基因筛查对于HMTC的预防性干预和晚期MTC的个体化治疗具有重要意义,相关的遗传咨询和治疗策略在国内仍然有待发展。MTC的诊断仍以病史询问、体格检查、影像学检查(彩超、CT、MRI)、实验室检查(Ctn、CEA)和FNA病理为主。在此基础上,核医学科检查的意义主要在于为生化复发的MTC病人寻找潜在复发病灶,诊断准确率的提升依赖于新型显像剂和检测模式的研究。外科手术是MTC惟一的根治性治疗方式,手术指征近年来无明显变化,主要的争议集中于预防性颈部淋巴结清扫的指征和范围。此外,散发性和HMTC的手术范围略有不同。散发性和HMTC均可伴有多种甲状腺外器官病变,包括肾上腺、甲状旁腺、激素异常分泌相关症状等,因此,完善的MTC治疗策略是一种综合治疗,建立在详细的全身评估基础上,需要在合适的治疗时机联合应用多种治疗手段。局部晚期不可手术和远处转移性MTC是当前MTC治疗中的主要挑战,靶向治疗是其主要的治疗选择。多个药物已于欧美获批进入临床应用,但未在国内上市。对于此类病人均建议筛选参加相关的临床试验。当前MTC靶向治疗模式主要有两个方向:(1)围绕免疫抑制靶点的联合用药方案。(2)针对局部晚期不可手术病人的新辅助治疗模式,前者已在其他肿瘤中有较多报道,且已具备丰富的机制研究基础,后者主要以临床试验的形式展开,值得期待。以上内容摘自:中国医师协会外科医师分会甲状腺外科医师委员会,中国抗癌协会甲状腺癌专业委员会,中国研究型医院学会甲状腺疾病专业委员会.甲状腺髓样癌诊断与治疗中国专家共识(2020版)[J]. 中国实用外科杂志,2020,40(9):1012-1020.
曹卫医生的科普号 2021年06月05日
2021年06月05日 4702
4702
 2
2
 10
10
-
甲状腺髓样癌术后降钙素不下降怎么办?
很多甲状腺髓样癌患者时候降钙素不能降至正常水平,那么接下来怎么办?首先我们需要再次颈部超声CT,MRI检查以了解是否有残留病灶或者复发病灶,如果有在有切除条件的情况下可以再次手术切除(建议再次手术的患者前往全国大型三甲名院就诊)。如果颈部未发现病灶则需全身筛查,甚至需要做全身的奥曲肽显像,如果没有奥曲肽显像可以考虑全身PETCT筛查。如果所有影像学检查都无法确定病灶则只能密切随访观察,待明确病灶后再评估是否可以手术切除。 如不能手术切除则可以考虑是否行基因检测靶向治疗。化疗和放射治疗通常疗效不佳。
邓先兆医生的科普号 2021年05月15日
2021年05月15日 1775
1775
 0
0
 2
2
-
甲状腺髓样癌如何治疗
甲状腺髓样癌恶性相对乳头状癌和滤泡状癌而言,恶性程度更高,易复发转移。因此,对于甲状腺髓样癌我们建议首次手术一定要规范彻底,我们行甲状腺全切加中央区清扫,对于患者侧区我们也通常建议术中活检,若为阳性则需规范侧区清扫。如首次手术范围不够或者清扫不彻底再次手术想达到生化缓解将十分困难。
邓先兆医生的科普号 2021年04月28日
2021年04月28日 1721
1721
 0
0
 0
0
-
甲状腺常见的恶性肿瘤及其预后
甲状腺常见的四种恶性肿瘤是:乳头状癌、滤泡癌、髓样癌、未分化癌。其中乳头状癌和滤泡癌统称为分化型甲状腺癌,这两种预后相对较好,早期手术治疗可以取得相对较好的治疗效果,当然晚期的也会出现一些难以治疗的情况。 髓样癌一般具有家族性遗传倾向,尤其是可能会是多发性内分泌肿瘤,比如垂体、肾上腺、胰腺等内分泌器官的合并疾病,其预后介于分化型甲状腺癌和未分化甲状腺癌之间,预后相对还可以,当然也要结合手术时有无转移,其预后可以从几个月到几十年。 未分化癌是预后最差的肿瘤,一般生存期可能只有几个月,是比较少见的肿瘤。 还有一些其他类型的肿瘤,比如淋巴瘤,低分化癌等,其预后和病理类型密切相关
李大勇医生的科普号 2021年04月18日
2021年04月18日 1821
1821
 0
0
 0
0
-
指南与共识|甲状腺髓样癌诊断与治疗中国专家共识(2020版)
甲状腺髓样癌诊断与治疗中国专家共识(2020版)中国医师协会外科医师分会甲状腺外科医师委员会中国抗癌协会甲状腺癌专业委员会中国研究型医院学会甲状腺疾病专业委员会中国实用外科杂志,2020,40(9):1012-1020 甲状腺癌病人中,90%以上为分化型甲状腺癌(differentiated thyroid cancer,DTC),而甲状腺髓样癌(medullary thyroid carcinoma,MTC)的发病率较低,且有其独特的临床病理特征,故而误诊、漏诊和不规范治疗现象仍然普遍存在。 MTC是起源于甲状腺滤泡旁细胞(C细胞)的恶性肿瘤。C细胞属于APUD系统,具有合成分泌降钙素(calcitonin,Ctn)及降钙素基因相关肽的作用,因此,MTC亦被认为是神经内分泌肿瘤之一。MTC在临床分型、诊断、治疗、随访及预后等多个方面与DTC均有所差异,故包括美国甲状腺协会(ATA)在内的多个机构都针对MTC制订了独立的临床诊治指南。为进一步提高我国MTC的诊治水平并提供更加合理及规范的诊治方案,中国医师协会外科医师分会甲状腺外科医师委员会、中国抗癌协会甲状腺癌专业委员会、中国研究型医院学会甲状腺疾病专业委员会结合近年来MTC领域的最新临床研究成果和国内实际的诊治现状,特制定本共识。1 MTC的分类及流行病学根据疾病的遗传特性,将MTC分为遗传性和散发性两大类。几乎所有的遗传性MTC(hereditary medullary thyroid cancer,HMTC)都伴有RET基因的胚系突变,50%的散发性MTC有RET基因的体细胞突变[1]。散发性MTC发病率较高,占发病总数的75%~80%;遗传性MTC则多以多发性内分泌肿瘤综合征2型(MEN2)中的一部分发病,根据最新的ATA甲状腺髓样癌临床指南描述,可分为多发性内分泌腺瘤2A(MEN2A)和多发性内分泌腺瘤2B(MEN2B)。1.1 MEN2A 约占所有MEN2病人的95%,又可分为4个亚型。1.1.1 经典型MEN2A 最为常见,除了MTC外还可并发嗜铬细胞瘤和(或)甲状旁腺功能亢进(hyperparathyroidism,HPTH)。95%的病人RET基因突变在10号外显子的第609、611、618、620以及11号外显子的第634密码子[2]。1.1.2 MEN2A伴皮肤苔藓淀粉样变(CLA) CLA的典型临床表现为脊柱T2-T6对应的背部肩胛区皮肤病损和瘙痒[3],几乎所有该类病人均携带RET基因第634密码子突变[4]。1.1.3 MEN2A伴先天性巨结肠(HD) 约占MEN2A的7%[5],一般由于RET基因10号外显子突变所致[6]。1.1.4 家族非多发性内分泌肿瘤性MTC(FMTC) 即携带RET基因胚系突变但不合并嗜铬细胞瘤或HPTH的FMTC。1.2 MEN2B 以MTC并发黏膜多发性神经瘤为特点,50%的病人还可伴有肾上腺嗜铬细胞瘤(pheochromocytoma,PHEO),一般不伴有HPTH。除此之外大部分病人还可表现为Marfan征外貌、眼部异常、骨骼畸形、消化道梗阻及其他临床表现。该类型恶性程度最高,早期即可发生淋巴结甚至远处转移。95%的MEN2B病人携带RET基因第16号外显子M918T突变,不足5%的病人携带15号外显子A883F突变[7]。2 RET基因筛查、遗传咨询及干预时机2.1 RET基因筛查和遗传咨询 临床上1%~7%的散发性MTC病人实际具有遗传性MTC的基因背景,因此,散发性病例行基因筛查可进一步明确疾病分型[8]。对于MTC基因筛查的目的主要有两方面:(1)在家系成员中排查特定种类的遗传性MTC。(2)根据不同的突变位点进行危险分层,以期有针对性地制定治疗策略。对于遗传性MTC病人,应常规告知病人,遗传性RET突变可能给家庭成员带来的风险,育龄的RET突变携带者,尤其是MEN2B型,建议进行孕前或产前的遗传咨询。推荐1:对于以下人群可推荐进行RET基因筛查和遗传咨询:(1)散发性MTC病人本人。(2)遗传性MTC病人本人及一级亲属。(3)在儿童或婴儿期出现MEN2B表现病人的父母。(4)皮肤苔藓淀粉样变的病人。(5)先天性巨结肠病病人,携带RET基因10号外显子突变。(证据等级:D;推荐等级:B)推荐2:进行RET基因筛查的具体目标位点包括:(1)MEN2A的基因筛查。需要检查的RET基因突变位点主要包括10号外显子的第609、611、618、620密码子、11号外显子的第630、634密码子。若上述检查未发现明确的突变位点,或临床表型与检查结果不一致时,应进一步采用RET基因编码区全测序进行筛查。(2)MEN2B的基因筛查:需要检查的RET基因突变位点主要包括16号外显子的M918T突变和15号外显子的A883F突变,若结果为阴性则行需要RET基因编码区全测序。(证据等级:D;推荐等级:A)推荐3:除计划使用选择性RET抑制剂治疗晚期MTC外,不常规筛查MTC病人的体系RET突变。(证据等级:D;推荐等级:B)推荐4:在十分罕见的家系中,会出现受检者符合MEN2A或MEN2B临床诊断标准,但整个RET编码区均没有基因突变的情况。这种情况下有风险的亲属应当采用传统的筛查MTC、嗜铬细胞瘤以及HPTH的方法来进行阶段性检查。(证据等级:D;推荐等级:B)2.2 基于RET突变位点的危险度分层 目前发现与遗传性MTC有关的RET基因突变、插入、缺失位点>100个,而导致肿瘤发病的常为单点突变,少见双点甚至多点突变。不同类型的MTC对应不同的RET基因突变位点,不同的突变位点所致肿瘤的恶性程度亦不相同。推荐5:对于遗传性MTC根据不同的突变位点进行风险分层。可分为3级:(1)最高风险(HST)。包括MEN2B病人和RET密码子M918T突变。(2)高风险(H)。包括RET密码子C634突变和A883F突变。(3)中等风险(MOD)。包括遗传性MTC病人中除M918T、C634、A883F突变之外的病人。(证据等级:D;推荐等级:B)2.3 遗传性MTC的干预时机2.3.1 MEN2A儿童遗传性MTC的预防性甲状腺切除 高风险类别儿童通常在出生后几年就发展为MTC,因此,应从3岁开始每年进行查体、颈部超声和血清Ctn水平检查[9]。中风险类别的儿童通常稍年长时发展出侵袭性较低的MTC[10],因此,建议中风险类别儿童从5岁起每年进行体检,行颈部超声和Ctn检查。高风险类别儿童应在5岁之前进行甲状腺切除术,并根据Ctn水平指导手术时间和范围。中风险类别的儿童应在儿童期或成年期进行甲状腺切除术,手术时间主要取决于Ctn水平。一项纳入14例MEN2A患儿的回顾性研究表明,即使患儿已出现微小(≤1 cm)的MTC病灶,预防性全甲状腺切除术一般已足够安全可靠[11]。2.3.2 MEN2B儿童遗传性MTC的预防性甲状腺切除 对于MEN2B和携带RET密码子M918T突变的极高风险病人,应尽早行甲状腺切除术。最近的一项纳入345例MEN2B病人的全球多中心回顾性研究显示,在1岁以前行甲状腺切除术能够显著降低复发风险[12]。因此,极高危类别婴儿出生后应立即进行基因检测,具体干预时间由外科医生或儿科医生与患儿父母沟通决定。推荐6:MEN2A/B患儿在充分评估手术获益与并发症风险的基础上,可考虑早期手术干预。具体治疗措施应与患儿监护人充分沟通。(证据等级:C;推荐等级:C)推荐7:极高风险类别中具有RET密码子M918T突变的患儿,推荐干预时间为出生的第一年内进行甲状腺切除术。术者应与患儿监护人协商,决定行甲状腺切除术的时机。开展首例手术时,应获得所在医院伦理委员会审批通过。(证据等级:C;推荐等级:C)推荐8:高风险类患儿推荐干预时间为5岁或更早时行甲状腺切除术,具体时机取决于是否发现肿瘤形成及血清Ctn升高的水平。(证据等级:C;推荐等级:B)推荐9:中风险类别的患儿推荐从5岁开始进行体格检查,颈部超声和血清Ctn水平检测。行甲状腺切除术的时机应取决于是否发现肿瘤形成及血清Ctn升高的水平。(证据等级:C;推荐等级:B)注:以上与预防性手术的相关推荐,因国内文献极少,主要参考国外MTC指南。考虑中国实际国情,国内缺乏相关经验,亦缺乏相关的法律条文指引,建议在与患儿监护人充分沟通后方可参考。3 MTC的初始诊断评估3.1 MTC的生物标记物检测3.1.1 Ctn Ctn是一类多肽类激素,主要由甲状腺滤泡旁C细胞表达并分泌释放,故在MTC病人中特征性地表达。多个大样本前瞻性非随机对照研究证实,对甲状腺结节病人常规筛查血清Ctn能提高MTC的检出率及总体存活率[13]。我国学者的一项大型回顾性研究显示血清Ctn对于诊断MTC的灵敏度、特异度均较高,同时其检测费用相对较低[14]。我国于2017年发布的《甲状腺癌血清标志物临床应用专家共识》[15]推荐对于怀疑恶性的甲状腺肿瘤病人,术前应常规行血清Ctn检测。考虑检测方法的差别及更新,血清Ctn尚无统一的参考范围。2015年ATA颁布的MTC诊治指南建议各诊疗单位可根据大样本对比研究确定各自的参考值范围,并强调对于同一病人病情判断,应采用与基线一致的检测方法(注:考虑到不同文献报道中Ctn的检测方法与参考范围亦存在差异,因此本共识中所有提及的Ctn具体数值均以相关的参考文献为准)。Ctn在肝脏和肾脏中代谢,其表达水平主要受血钙浓度的调节。须注意的是,血清Ctn水平可以受生理作用、病理作用、药理作用等多方面因素的影响。另外,对于肿瘤负荷较大,而血清Ctn阴性的病人,须注意免疫分析法的“脱钩现象”导致的假阴性可能。推荐10:对于怀疑恶性的甲状腺肿瘤病人,术前可考虑常规检测血清Ctn以对MTC进行筛查。(证据等级:C;推荐等级:A)推荐11:由于各大中心采用的检测方法不同,在对同一MTC病人进行血清Ctn监测时,建议采用与基线相同的检测方法。(证据等级:C;推荐等级:B)推荐12:国人对于预防性甲状腺手术接受率低,基因筛查普及率低。因此,对HMTC 家系突变基因携带者需采取密切影像学及血清Ctn变化随访。(证据等级:C;推荐等级:B)推荐13:术前血清Ctn的升高水平与MTC病人体内肿瘤负荷相关,结合影像学检查有助于评估病情及制定治疗决策。(证据等级:C;推荐等级:C)3.1.2 癌胚抗原 除Ctn外,C细胞也能分泌癌胚抗原(carcinoembryonic antigen,CEA),因此,MTC病人的CEA水平也可能升高。尽管CEA的特异性不强,无法作为一个理想的MTC筛查指标,但一经诊断为MTC,仍建议同时检测血清Ctn和CEA浓度作为诊断和随访指标。部分MTC病人可表现为血清Ctn和CEA均低表达(非分泌型MTC)。一项纳入839例散发型MTC病人的研究中,非分泌型MTC病人占0.83%。该类病人肿瘤分化差、Ki-67较高、M918T突变更多见[16]。推荐14:对于MTC诊断明确的病人,建议在术前同时检测血清Ctn和CEA水平。以CEA升高为首发症状就诊的病人,在排除消化道肿瘤后,建议补充Ctn及颈部超声检查。(证据等级:C;推荐等级:A)推荐15:CEA升高程度与肿瘤外侵、淋巴结转移和远处转移呈正相关,可与 Ctn一起用于评估疾病风险。(证据等级:C;推荐等级:B)推荐16:CEA升高与MTC肿瘤去分化相关,可作为根治术后监测肿瘤进展指标。(证据等级:C;推荐等级:B)3.2 辅助检查3.2.1 颈部超声检查 超声检查是评估甲状腺恶性肿瘤最重要的影像学手段,首选用于甲状腺结节和颈部淋巴结的定性诊断。超声下MTC和转移性颈淋巴结的声像图特征大多和DTC类似。尽管超声检查与操作者的经验密切相关,但与增强CT相比,超声检查的敏感度、特异度和准确率均高于增强CT。推荐17:建议对所有的MTC可疑病人进行全面的病史收集、体格检查和颈部超声检查。(证据等级:C;推荐等级:A)。3.2.2 MTC的细针穿刺活检 B超引导下细针穿刺活检(fine needle aspiration,FNA)是重要的术前病理学诊断手段[17]。国内外相关指南中,甲状腺结节的穿刺指征类似,可参考我国发布的《超声引导下甲状腺结节细针穿刺活检专家共识及操作指南(2018 版)》[18]。在此基础上,若出现血清Ctn/CEA水平异常升高,穿刺指针可更加积极。穿刺冲洗液的Ctn检测以及免疫组化染色有助于提高MTC的确诊率[19]。推荐18:在现有各大指南针对甲状腺结节的穿刺指征基础上,当出现CEA、Ctn升高时,细胞学检查应更为积极。(证据等级:C;推荐等级:C)3.2.3 RET突变检测 MTC病人中RET基因突变最为常见,且不同突变位点对应不同的临床行为和预后特点。前文已述,可根据RET基因突变位点的不同,对HMTC进行基因筛选、遗传咨询并据此确立早期干预策略(详见“分子检测与遗传咨询”部分)。而对于散发性MTC,目前已有观点认为,基于不同突变位点的危险分层体系在将来同样可应用于散发性MTC的精细化诊治,但现阶段证据仍然不足。高选择性RET抑制剂的出现,显然将加速该观点的推进。推荐19:RET基因检测对散发型MTC病人危险分层以指导诊治具有重要价值。可以结合病人个体化需求及操作可行性,实施MTC基因分型检测。(证据等级:C;推荐等级:C)3.2.4 其他辅助检查 多数研究者及指南认为应在术前对MTC病人进行系统性的影像学评估。CT对颈部、纵隔淋巴结病变及肺转移灶敏感[20]。MRI对判断肝脏转移灶更为有效,同时轴位MRI和骨显像是最常用且最敏感的骨转移评估方法。核医学显像方面,99mTc-MDP骨显像可用于骨转移灶的排查。另外,18F-FDG PET-CT和18F-DOPA也可用于MTC转移灶的评估,但由于检测灵敏度较低且价格昂贵,ATA指南不推荐两者作为远处转移的常规检查手段。但当血清Ctn升高或血清Ctn倍增时间缩短时,18F-FDG、18F-DOPA和68Ga-生长抑素受体显像可考虑用于评估MTC病人的复发/转移[21]。除评估肿瘤累及范围外,还须仔细检查MTC病人是否合并PHEO和HPTH,尤其是对HMTC病人,避免手术麻醉风险。推荐20:MTC病人术前须接受系统性的影像学评估,明确肿瘤累及范围,为后续治疗提供客观依据。(证据等级:C;推荐等级:B)推荐21:PET-CT对术前分期的作用有限,当血清Ctn浓度较高或血清Ctn倍增时间较快时,18F-FDG、18F-DOPA和68Ga-生长抑素受体显像可用于评估MTC病人的复发/转移。(证据等级:C;推荐等级:C)推荐22:对于确诊MTC者,应常规筛查是否合并肾上腺嗜铬细胞瘤和甲状旁腺功能亢进症。(证据等级:C;推荐等级:B)4 初治可手术MTC的临床治疗4.1 MTC的外科治疗 手术是目前首选且惟一被证明可以治愈MTC的方法,传统的放化疗则对本病疗效不佳。针对DTC的放射性碘治疗同样不适用于本病病人。对于合并甲状腺外病变的病人,相关治疗应同步进行。4.1.1 原发灶手术治疗 目前国内外对HMTC的原发灶治疗的意见趋于统一。即无论是否存在远处转移病灶,对于原发灶可手术的病人,全甲状腺切除术均应作为初始的手术治疗方式。而对于散发性MTC病人,由于其较高的多灶和双侧发病概率,主流意见仍推荐将全甲状腺切除作为初始的手术治疗方式。少部分中心认为对于术前彩超及影像学检查仅考虑单侧且病灶较小的散发性病人,可考虑行患侧腺叶加峡部切除术[22]。针对此种意见,目前尚缺少足够的循证医学证据,需要大样本临床研究数据支持。推荐23:对于基因检测已明确或有明确家族史的HMTC,无论肿瘤大小,单侧还是双侧病灶,均应行全甲状腺切除术。(证据等级:C;推荐等级:A)推荐24:对于基因检测已明确的散发性MTC,可行全甲状腺切除术;此类病人若病灶局限于单侧甲状腺,且无其他危险因素时可行腺叶切除术全甲状腺切除术。(证据等级:D;推荐等级:B)推荐25:对于未行基因检测、无明确家族史的MTC,建议行全甲状腺切除术。(证据等级:C;推荐等级:C)4.1.2 颈部淋巴结转移灶手术治疗4.1.2.1 中央区淋巴结清扫的指征 无论是散发性或HMTC,cN1a病人均应行治疗性中央区淋巴结清扫。对于cN0病人,目前国外各大指南均推荐在全甲状腺切除的基础上行双侧预防性中央区清扫术(prophylactic central neck dissection,PCND)。这一结论基于:(1)无论肿瘤大小,MTC的中央区淋巴结转移发生率均较高(50%~75%)。(2)术前和术中对于中央区淋巴结评估的准确率并不令人满意[23]。(3)回顾性研究显示PCND有助于改善病人预后。4.1.2.2 侧颈淋巴结清扫的指征 对于所有MTC病人,cN1b均提示须行治疗性侧颈淋巴结清扫,而对于cN0病人的预防性侧颈清扫,则仍存在争议。有研究表明,侧颈淋巴结转移率与颈中央区淋巴结转移数量密切相关,≥4枚中央区淋巴结转移时,同侧侧颈淋巴结转移率最高可达到98%[24]。术前基础血清Ctn水平也可部分反应淋巴结转移程度[25]。推荐26:cN0的MTC病人建议行预防性中央区淋巴结清扫。(证据等级:C;推荐等级:A)推荐27:大多数cN0的MTC病人无须行预防性侧颈淋巴结清扫,但仍须结合中央区淋巴结转移情况、血清Ctn水平和原发灶负荷等因素综合考虑。(证据等级:C;推荐等级:D)推荐28:(1)对于术前淋巴结分期为cN1a的MTC病人,应行中央区淋巴结清扫。(2)对于术前淋巴结分期为cN1b的MTC病人,应行侧颈区和中央区淋巴结清扫。(证据等级:C;推荐等级:A)4.1.2.3 上纵隔淋巴结清扫推荐29:对于中央区淋巴结较大或较多者建议行选择性上纵隔清扫,对于有明确的上纵隔淋巴结转移证据的病人,须根据临床特征进行区别处理。(证据等级:C;推荐等级:B)4.2 MTC的外放射治疗 MTC局部复发的危险因素主要包括甲状腺外侵犯、术后病灶残留、临床分期晚、淋巴结阳性和纵隔受侵[26]。当初始手术治疗无法达到根治目的时,可以考虑应用外放射疗法(EBRT)进行治疗以提高局部控制率。但目前尚无令人信服的证据证明术后EBRT对 MTC病人的总存活率的影响。与此同时,适当的EBRT可应用于转移性MTC的姑息治疗,例如疼痛性骨转移、纵隔或肺部转移引起的呼吸困难或咯血症状、保护颈部重要结构等。推荐30:当病人局部复发风险较高时,可考虑对颈部和(或)纵隔区进行外照射放疗。做出EBRT治疗决策前,应综合考虑治疗带来的获益和副反应。(证据等级:C;推荐等级:C)4.3 术后激素替代治疗 全甲状腺切除术后病人应常规给予甲状腺素替代治疗。由于滤泡旁细胞肿瘤不依赖促甲状腺激素,并且没有证据显示TSH抑制疗法可降低MTC病人术后的复发率或提高存活率,所以MTC行全甲状腺切除术后无须对TSH水平进行过度抑制。推荐31:术后采用左旋甲状腺素行甲状腺功能的替代治疗,仅当合并DTC时,按照DTC风险分层进行TSH抑制处理。(证据等级:C;推荐等级:C)4.4 术后放射性碘治疗 MTC病灶并不摄碘,有研究认为术后131I可以通过摄碘的甲状腺组织对MTC细胞达到间接辐射作用,或通过消除残余的甲状腺组织来达到减少复发的目的[27],但近期研究显示MTC病人的术后131I治疗并未降低其疾病特异性死亡风险,不推荐MTC病人行术后131I治疗。然而,对于MTC同时伴有DTC的病人,应结合其DTC部分的临床病理特征决定是否使用131I治疗。推荐32:对于不伴有DTC的MTC,不推荐行131I同位素治疗。(证据等级:C;推荐等级:B)4.5 伴有PHEO的MEN2A和MEN2B病人的治疗推荐33:MEN2病人一经确诊,建议尽早行PHEO的筛查,筛查方法可包括血浆肾上腺素和去甲肾上腺素检测,24 h尿儿茶酚胺检测,以及肾上腺CT和(或)MRI等。(证据等级:C;推荐等级:C)推荐34:MEN2A和MEN2B病人在行任何手术之前,均应行相关检查排除PHEO。女性病人备孕前,应排除PHEO;若孕期检查发现已有PHEO病灶,应尽可能在妊娠期第3个月之前手术切除。(证据等级:D;推荐等级:C)4.6 MEN2A病人HPTH的处理推荐35:MEN2A病人一经确诊,应在行PHEO筛查的同时筛查HPTH。(证据等级:D;推荐等级:B)推荐36:术中仅需切除肉眼可见的增生甲状旁腺,如果4个甲状旁腺均有增生,则可取一小块甲状旁腺腺体带血管蒂原位保留,其余旁腺切除;或者行全甲状旁腺切除术,将旁腺异位移植。(证据等级:D;推荐等级:B)推荐37:MEN2A病人行甲状腺切除术后如果发现HPTH,再次手术之前,应进行增生旁腺的定位检查。再次手术时,应切除所有肉眼增生的甲状旁腺,并将正常大小的旁腺原位保留。若术中发现单个甲状旁腺增大,并且有病理学证据表明先前已切除了3个甲状旁腺腺体,则应将一部分腺体带血管蒂原位保留,或者将腺体切除后将其异位移植。(证据等级:D;推荐等级:B)5 局部晚期不可手术及远处转移性MTC的临床治疗5.1 局部晚期不可手术MTC的治疗 总体上MTC的侵袭性高于DTC,因此,临床上可以观察到更多MTC病人在初次就诊时原发灶或区域淋巴结即已进展至局部晚期,R0切除的机会极低,且需要付出多种器官功能丧失的代价。对于此类病人,传统的外科/放疗/化疗多学科治疗模式所能获得的疗效有限,预后较差。近年来,随着靶向药物的发展,目前已有多种多靶点的小分子酪氨酸激酶抑制剂,被报道对不可切除的局部晚期MTC有效,包括凡德他尼、卡博替尼、乐伐替尼、安罗替尼、索凡替尼、阿西替尼等[28-32],其中凡德他尼和卡博替尼已被欧美批准用于局部晚期或远处转移性MTC的临床治疗。值得一提的是,以上临床试验均以总体的有效率、无病存活率或总存活率作为研究终点。那么应用靶向药物后,原局部晚期不可切除的病灶是否可降期为可手术病灶,或在原手术范围基础上提高器官保留率,当前的报道仍然缺乏,但类似的临床试验招募已在国内和欧美的各大癌症中心逐渐开始。另一方面,亦有研究显示传统外放射治疗对部分局部晚期MTC有效,Rowell等[33]在对27个回顾性研究进行系统综述后发现,约有21%(13/63)的病人在接受外放疗后,局部病灶达到完全缓解,但该研究未涉及MTC的预后评估。推荐38:对局部晚期不可手术的MTC病人可考虑参加相关临床试验,或行系统治疗。对于复发性髓样癌,也可考虑放疗,参见推荐53。(证据等级:C;推荐等级:B)5.2 全身系统治疗 转移性MTC尚无法治愈,总体治疗目标是提高局部控制率、缓解全身症状与转移灶症状、减少疾病相关死亡。部分晚期病人疾病进展缓慢,因此,目前不推荐对无症状且无明确病灶的病人进行治疗。当出现明确病灶时,医生需要衡量肿瘤生长速度、生活质量与治疗毒性之间的关系,合理选择治疗方案。5.2.1 靶向治疗 MTC具有众多基因突变,是系统治疗的潜在靶点。几乎所有MEN2和半数的散发性MTC病人中都存在体细胞RET突变。在RET野生型的病人中,18%~80%具有体细胞RAS突变。另外,血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)也在MTC肿瘤细胞中高表达[34]。众多酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)药物涵盖了MTC的治疗靶点,并在晚期MTC中进行了多项临床试验。然而,目前有Ⅲ期随机对照临床试验证据的靶向药物凡德他尼、卡博替尼均未在中国上市,部分有Ⅱ期临床试验证据的药物在MTC中的适应证也未获批。近期文献报道,MTC伴随大量免疫细胞浸润与免疫分子表达,其中PD-L1表达与肿瘤复发相关,提示免疫检查点抑制剂在晚期MTC中有潜在治疗价值[35]。推荐39:影像学评估病灶稳定、肿瘤负荷小且血清Ctn和CEA倍增时间>2年的晚期MTC病人,不应给予系统治疗。(证据等级:C;推荐等级:B)推荐40:进展性、晚期MTC病人首选加入设计良好的临床试验。(证据等级:D;推荐等级:C)5.2.1.1 多靶点酪氨酸激酶抑制剂 凡德他尼是一个口服的小分子多靶点TKI,其主要作用靶点为RET、EGFR和VEGFR。基于一项前瞻性、随机双盲、对比凡德他尼和安慰剂治疗局部晚期或转移性MTC的Ⅲ期临床试验(ZETA)的结果,美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)于2011年批准凡德他尼用于治疗进展性、有症状的、不可手术的局部晚期或转移性MTC。卡博替尼的主要治疗靶点为RET,MET和VEGFR2,也是一个口服的小分子多靶点TKI。基于一项前瞻性、随机双盲、对比卡博替尼和安慰剂治疗影像学进展的转移性MTC的Ⅲ期临床试验(EXAM)的结果[36]。目前已被FDA和EMA批准上市,用于治疗晚期转移性MTC。盐酸安罗替尼是我国自主研发的多靶点TKI,主要作用于VEGFR2/3、成纤维细胞生长因子受体1-4(FGFR1-4)及血小板源生长因子受体(PDGFR)。在单臂、多中心的Ⅱ期的临床研究中,共有58例局部晚期或远处转移的MTC入组,56.9% 达到部分缓解。48周的PFS率为85.5%,45例病人的Ctn较基线下降>50%[31]。目前安罗替尼已向SFDA递交申请用于无法手术的局部晚期或转移性甲状腺髓样癌病人的治疗。索拉非尼用于碘治疗抵抗的DTC的适应证已经在国内获批,其在晚期MTC中也有一定疗效[37]。日本的小样本Ⅱ期研究报道,索拉非尼治疗MTC的客观缓解率为25%,疾病控制率为75%,其安全性与既往报道一致[38]。索凡替尼的作用靶点为VEGFR,FGFR-1以及集落刺激因子1受体(colony-stimulating factor-1 receptor,CSF1R)。在我国的多中心Ⅱ期临床研究中,纳入了27例MTC病人,客观缓解率为22.2%,中位PFS为11.1个月。乐伐替尼在欧美国家已获批用于碘治疗抵抗的DTC,但在MTC中只有Ⅱ期临床研究的结果。在一项纳入58例晚期、进展性MTC的临床试验中,乐伐替尼的客观缓解率为36%,中位反应时间为3.5个月,中位PFS为9个月,疾病控制率达80%[30]。5.2.1.2 高选择性RET抑制剂 RET是MTC的主要驱动基因,也是治疗MTC潜在最有效的靶点。高选择性的RET抑制剂与之前的多靶点TKI不同,其对RET的亲和力高,对于RET的融合突变及点突变均有效。目前已有两个小分子高选择性RET抑制剂,分别为BLU-667和LOXO-292,均在临床试验阶段。初步研究报道,两个药物对既往接受过TKI治疗、或TKI耐药的MTC也有一定疗效,不良反应可控[39-40]。其中LOXO-292因其在Ⅰ/Ⅱ期临床试验中表现出的良好疗效,已被美国FDA加速获批上市。推荐41:靶向治疗是晚期远处转移性MTC的一线系统治疗方案。(证据等级:A;推荐等级:A)5.2.2 化疗 单药或联合化疗治疗MTC的反应率较低,且维持时间较短。其中,最有效的方案是5-氟尿嘧啶和达卡巴嗪联合治疗,小规模病例报道中ORR为60%~75%,缓解时间约维持9个月[41]。另有阿霉素联合5-氟尿嘧啶、达卡巴嗪的化疗方案,在20例病人的队列中,3例部分缓解,10例病情稳定[42]。5.2.3 放射性同位素治疗 应用放射性核素标记的分子治疗晚期MTC的经验有限。在一项应用[90Y-DOTA]-TOC治疗晚期MTC的Ⅱ期临床试验中,18例(58.1%)Ctn的倍增时间较前延长1倍,9例(29%)Ctn水平较前降低。Ctn水平降低者的中位生存期显著延长[43]。在核素显像阳性的病人中,应用131I-MIBG和111In-奥曲肽和177Lu-生长抑素类似物治疗可以使部分病人疾病稳定甚至缓解,可作为姑息治疗的选择[44-46]。由于缺乏高质量循证医学证据,目前仅推荐在设计良好的临床试验中利用放射性同位素治疗晚期MTC。5.3 远处转移病灶的局部治疗 MTC病人较DTC更易出现远处转移,常见的转移部位包括肺、骨、脑、肝等,根据转移部位不同,可采取相应的局部治疗方式。推荐42:MTC单发脑转移可进行手术切除或立体定向放射外科治疗;多发脑转移可进行全脑放疗。(证据等级:D;推荐等级:C)推荐43:骨转移病人出现脊髓压迫症状可进行激素冲击治疗和手术减压。放疗可缓解骨转移导致的骨痛症状。(证据等级:D;推荐等级:C)推荐44:骨转移病人可从双膦酸盐或地舒单抗的治疗中获益。(证据等级:D;推荐等级:B)推荐45:局限性、有症状的肺及纵隔转移可考虑局部治疗;多发、进展性的肺及纵隔转移首选系统治疗。(证据等级:D;推荐等级:C)推荐46:多发肝转移可行肝动脉栓塞化疗。(证据等级:C;推荐等级:B)5.4 激素相关症状的治疗5.4.1 腹泻 晚期MTC病人往往伴随腹泻,腹泻可影响病人的生活质量和营养状况,故腹泻严重者应予对症治疗。一般治疗包括禁酒、限制高纤维食物的摄入,如无改善,则考虑药物治疗。腹泻的一线治疗药物包括抗胃肠动力药物洛哌丁胺、阿托品及可待因,其副反应较小。5.4.2 异位Cushing综合征 除Ctn外,MTC偶尔可分泌其他激素,如CRH或ACTH,导致异位Cushing综合征的发生。降低皮质醇的方法包括:治疗肝脏转移灶(手术或化疗栓塞)、药物治疗(酮康唑、米非司酮、氨基谷氨酰胺、甲吡酮或米托坦)、及双侧肾上腺切除术[47]。推荐47:MTC病人合并Cushing综合征者预后差,应予积极治疗。治疗策略包括药物治疗及双侧肾上腺切除等。(证据等级:D;推荐等级:C)6 MTC的随访监测6.1 初次手术疗效及复发风险评估 MTC初次手术后,应对病人的手术治疗效果和复发转移风险进行评估,以便于制定进一步的治疗随访计划。MTC的预后主要与病人初次诊断时的肿瘤分期以及手术切除效果有关,另外,病人的年龄,基因突变位点,术后Ctn倍增时间等因素也与预后密切相关。初次手术治疗效果是预后的关键因素,2013年Tuttle和 Ganly仿照DTC提出MTC的动态复发风险分层,将MTC初次术后的病人分为4类:(1)生化治愈。手术完整切除肿瘤,Ctn降至检测水平以下。(2)解剖治愈。肿瘤标记物(Ctn素和CEA)升高,但无影像学可见病灶。(3)解剖残留。持续存在的解剖残留或远处转移。(4)疾病状态不确定。非特异的影像学异常、生化异常、或无法检测的解剖残留。生化治愈的病人10年存活率为95%~97%[48],Ctn持续升高的病人5年和10年存活率分别为80%~86%和70%[49]。推荐48:所有MTC病人均应进行终生随访,应根据基因突变,TNM分期,手术切除效果,术后Ctn及CEA水平以及倍增时间,确定随访内容和随访间隔。(证据等级:C;推荐等级:B)6.2 Ctn和CEA倍增时间 对于MTC来说,无论是术前诊断还是术后判断复发转移,Ctn的灵敏度和特异度都是最高的。由于Ctn半衰期长,术后过早检测Ctn可能对手术疗效评估不准确,尤其是当病人存在肝肾基础疾病或术前Ctn水平较高的情况下[50]。一项研究提示,淋巴结转移程度不同的病人,术后Ctn降至正常范围的时间存在差异,伴有淋巴结转移且术前Ctn>1000 ng/L的病人,Ctn降至正常的平均时间为57.7 d[51]。术后持续性Ctn升高并不一定提示肿瘤复发,但进行性升高的Ctn则与复发转移相关[52]。在一项包含65例病人的回顾性研究中,血清Ctn倍增时间<6个月的病人其5年和10年存活率分别为25%和8%,而倍增时间为6到24个月的病人其5年和10年存活率分别为92%和37%,倍增时间>24个月的病人在研究结束时均存活,且Ctn倍增时间是该研究多因素分析中惟一可作为独立预后因素的指标。对于MTC复发预测,CEA的特异度低于Ctn,在一项研究中,55例病人中,有80%Ctn和CEA倍增时间是一致的,因此,临床医生应当同时检测两项指标的倍增时间[53]。推荐49:初次手术后3个月应检测Ctn及CEA水平,评估手术疗效,肿瘤标记物低于检测水平以下的病人,可随访观察,随访间隔可设为6~12个月。(证据等级:C;推荐等级:B)推荐50:对于术后Ctn及CEA水平持续升高,或降至正常后再次升高的病人,应计算Ctn倍增时间,应至少连续检测4次,每次间隔至少6个月,病人随访间隔为3~6个月。(证据等级:C;推荐等级:B)6.3 Ctn升高病人的影像学检查推荐51:术后Ctn和CEA高于正常范围的病人应进行影像学检查积极寻找持续或复发病灶。初步的检查手段包括全身体格检查,颈部超声,颈胸部CT,腹部MRI,骨扫描,脊椎骨盆MRI,如仍未发现病灶,可进一步行18F-FDG,18F-DOPA和68Ga生长抑素受体为显像剂的PET-CT。(证据等级:C;推荐等级:C)7 复发性MTC的治疗7.1 二次手术 对于明确甲状腺局部或区域淋巴结残留/复发者,应考虑二次手术。淋巴结的清扫范围可涉及中央区、侧颈部及上纵隔淋巴结。约1/3的病人二次手术后Ctn可降至正常水平,且Ctn明显降低者后续发生远处转移的概率较小。但尚无前瞻性临床研究对比二次手术与观察随访的优劣。对于术前未诊断出MTC,行单侧腺叶切除术后病理确诊为MTC的病人,建议详细追问病史,有条件的单位可进一步行基因检测,若怀疑为HMTC,则建议行补充性对侧腺叶切除术和预防性中央区淋巴结清扫。若考虑为散发性MTC,且无明显危险因素,则无需常规行补充性对侧腺叶切除术。推荐52:对于仅有局部区域残留/复发,且可手术切除的病人应考虑二次手术。(证据等级:C;推荐等级:A)7.2 放射治疗 目前尚无随机对照临床研究评价放疗在局部区域复发MTC中的价值。2019年的一篇Meta分析显示,单纯放疗治疗局部区域残留/复发髓样的完全缓解率为21%,部分缓解率为41%,且29%的病人5年无局部区域复发。二次手术后的辅助放疗处理原则可参考初始治疗,并基于外科医生和放疗科医生的个体化选择。总体来讲,放疗可以改善高危病人的肿瘤局部控制率,但无法改善总生存,放疗在低危病人中疗效有限[54]。推荐53:对于无法手术的局部区域残留/复发病人,在权衡疗效和不良反应后,可考虑放疗。(证据等级:B;推荐等级:C)8 总结与展望基于RET基因突变位点的基因筛查对于HMTC的预防性干预和晚期MTC的个体化治疗具有重要意义,相关的遗传咨询和治疗策略在国内仍然有待发展。MTC的诊断仍以病史询问、体格检查、影像学检查(彩超、CT、MRI)、实验室检查(Ctn、CEA)和FNA病理为主。在此基础上,核医学科检查的意义主要在于为生化复发的MTC病人寻找潜在复发病灶,诊断准确率的提升依赖于新型显像剂和检测模式的研究。外科手术是MTC惟一的根治性治疗方式,手术指征近年来无明显变化,主要的争议集中于预防性颈部淋巴结清扫的指征和范围。此外,散发性和HMTC的手术范围略有不同。散发性和HMTC均可伴有多种甲状腺外器官病变,包括肾上腺、甲状旁腺、激素异常分泌相关症状等,因此,完善的MTC治疗策略是一种综合治疗,建立在详细的全身评估基础上,需要在合适的治疗时机联合应用多种治疗手段。局部晚期不可手术和远处转移性MTC是当前MTC治疗中的主要挑战,靶向治疗是其主要的治疗选择。多个药物已于欧美获批进入临床应用,但未在国内上市。对于此类病人均建议筛选参加相关的临床试验。当前MTC靶向治疗模式主要有两个方向:(1)围绕免疫抑制靶点的联合用药方案。(2)针对局部晚期不可手术病人的新辅助治疗模式,前者已在其他肿瘤中有较多报道,且已具备丰富的机制研究基础,后者主要以临床试验的形式展开,值得期待。声明:(1)本共识参考了2013年后国外现有的各大临床指南,在此基础上加入国内文献和证据。但对于部分内容,国内尚无相关报道或尚未临床普及,因此,使用时首先应从自身所在地区的实际情况出发,酌情进行参考。(2)实验室检查的检查方法和参考范围,各国各地区、各时间段均可存在差异,因此,本共识中的具体数值均为客观表述,以参考文献为准。使用时请根据实际情况进行转换,并且对比时尽量以同单位检查结果为参照。参考文献[1] Elisei R,Tacito A,Ramone T,et al.Twenty-five years experience on RET genetic screening on hereditary MTC: An update on the prevalence of germline RET mutations[J].Genes (Basel),2019,10(9):698.[2] Raue F,Frank-Raue K,Frank-Raue K.Genotype-phenotype correlation in multiple endocrine neoplasia type 2[J].Clinics (Sao Paulo),2012,67(suppl):69-75.[3] Verga U,Fugazzola L,Cambiaghi S,et al.Frequent association between MEN 2A and cutaneous lichen amyloidosis[J].Clin Endocrinol (Oxf),2003,59(2):156-161.[4] Amy E,Rothberg,Victoria M,et al.Familial medullary thyroid carcinoma associated with cutaneous lichen amyloidosis[J].Thyroid,2009,19:651-655.[5] Decker RA,Peacock ML,Peacock ML.Occurrence of MEN 2a in familial Hirschsprung's disease: a new indication for genetic testing of the RET proto-oncogene[J].J Pediatr Surg,1998,33(2):207-214.[6] Mulligan LM,Ponder BA. Genetic basis of endocrine disease: multiple endocrine neoplasia type 2[J].J Clin Endocrinol Metab,1995,80:1989-1995.[7] Smith DP,Houghton C,Ponder BA.Germline mutation of RET codon 883 in two cases of de novo MEN 2B[J].Oncogene,1997,15(10):1213-1217.[8] Iiguez-Ariza NM,Jasim S,Ryder MM,et al.Foundation one genomic interrogation of thyroid cancers in patients with metastatic disease requiring systemic therapy[J].J Clin Endocrinol Metab,2020,105(7):246.[9] Machens A,Gimm O,Hinze R,et al.Genotype-phenotype correlations in hereditary medullary thyroid carcinoma: oncological features and biochemical properties[J].J Clin Endocrinol Metab,2001,86(3):1104-1109.[10] Frohnauer MK,Decker RA,Decker RA.Update on the MEN 2A c804 RET mutation: is prophylactic thyroidectomy indicated?[J].Surgery,2000,128(6):1052-1057.[11] Garcés Visier C,Espinoza Vega M,Guillén Redondo P,et al.Prophylactic thyroidectomy in multiple endocrine neoplasia type 2A in children: a single centre experience[J].J Pediatr Endocrinol Metab,2019,32(8):889-893.[12] Castinetti F,Waguespack SG,Machens A,et al.Natural history, treatment, and long-term follow up of patients with multiple endocrine neoplasia type 2B: an international, multicentre, retrospective study[J].Lancet Diabetes Endocrinol,2019,7(3):213-220.[13] Chambon G,Alovisetti C,Idouxlouche C,et al.The use of preoperative routine measurement of basal serum thyrocalcitonin in candidates for thyroidectomy due to nodular thyroid disorders: results from 2733 consecutive patients[J].J Clin Endocrinol Metab,2011,96(1):75-81.[14] 殷德涛,张高朋,李红强,等.甲状腺结节患者常规行血清降钙素检查对早期发现甲状腺髓样癌的临床价值[J].中国普通外科杂志,2018,27(5):541-546.[15] 中国抗癌协会甲状腺癌专业委员会.甲状腺癌血清标志物临床应用专家共识(2017版)[J].中国肿瘤临床,2018,45(1):7-13.[16] Dora JM,Canalli MH,Capp C,et al.Normal perioperative serum calcitonin levels in patients with advanced medullary thyroid carcinoma: case report and review of the literature[J].Thyroid,2008,18(8):895-899.[17] Chen H,Sippel RS,Odorisio MS,et al.The North American Neuroendocrine Tumor Society consensus guideline for the diagnosis and management of neuroendocrine tumors: pheochromocytoma, paraganglioma, and medullary thyroid cancer[J].Pancreas,2010,39(6):775-783.[18] 中国医师协会外科医师分会甲状腺外科医师委员会,中国研究型医院学会甲状腺疾病专业委员会,中国医学装备协会外科装备分会甲状腺外科装备委员会. 超声引导下甲状腺结节细针穿刺活检专家共识及操作指南(2018版)[J].中国实用外科杂志,2018,38(3):241-244.[19] Dyhdalo KS,Chute DJ,Chute DJ.Barriers to the recognition of medullary thyroid carcinoma on FNA: Implications relevant to the new American Thyroid Association guidelines[J].Cancer Cytopathol,2018,126(6):397-405.[21] Jiang J,Yang Z,Zhang Y,et al.Clinical value of [(18)F]FDG-PET-CT in the detection of metastatic medullary thyroid cancer[J].Clin Imaging,2014,38(6):797-801.[22] Essig GF,Porter K,Schneider D,et al.Multifocality in sporadic medullary thyroid carcinoma: an international multicenter study[J].Thyroid,2016,26(11):1563-1572.[23] 刘溦薇,邓先兆,樊友本,等.散发性甲状腺髓样癌规范与非规范手术的效果观察[J].中国普外基础与临床杂志,2014,21(11):1408-1412.[24] Weber T,Schilling T,Frank-Raue K,et al.Impact of modified radical neck dissection on biochemical cure in medullary thyroid carcinomas[J].Surgery,2001,130(6):1044-1049.[25] Zhang L,Wei WJ,Ji QH,et al.Risk factors for neck nodal metastasis in papillary thyroid microcarcinoma: a study of 1066 patients[J].J Clin Endocrinol Metab,2012,97(4):1250-1257.[26] 高云飞,邓维叶,陈艳峰,等.甲状腺髓样癌预后相关因素分析(附118例报告)[J].中国实用外科杂志,2015,35(9):996-1000.[27] Deftos LJ,Stein MF.Radioiodine as an adjunct to the surgical treatment of medullary thyroid carcinoma[J].J Clin Endocrinol Metab,1980,50(5):967-968.[28] Wells SAJr,Robinson BG,Gagel RF,et al.Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial[J].J Clin Oncol,2012,30(2):134-141.[29] Tappenden P,Carroll C,Hamilton J,et al.Cabozantinib and vandetanib for unresectable locally advanced or metastatic medullary thyroid cancer: a systematic review and economic model[J].Health Technol Assess,2019,23(8):1-144.[30] Schlumberger M,Jarzab B,Cabanillas ME,et al.A phase II trial of the multitargeted tyrosine kinase inhibitor lenvatinib (E7080) in advanced medullary thyroid cancer[J].Clin Cancer Res,2016,22(1):44-53.[31] Yongkun S,Feng D,Ming G,et al.Anlotinib for the treatment of patients with locally advanced or metastatic medullary thyroid cancer[J].Thyroid,2018,28(11): 1455-1461.[32] Chen J,Ji Q,Bai C,et al.Surufatinib in Chinese patients with locally advanced or metastatic differentiated thyroid cancer and medullary thyroid cancer: A multicenter, open-label, Phase II trial[J].Thyroid. 2020 Apr 6. doi: 10.1089/thy.2019.0453. Online ahead of print.[33] Rowell NP.The role of external beam radiotherapy in the management of medullary carcinoma of the thyroid: A systematic review[J].Radiother Oncol,2019,136(2019):113-120.[34] Capp C,Wajner SM,Siqueira DR,et al.Increased expression of vascular endothelial growth factor and its receptors, VEGFR-1 and VEGFR-2, in medullary thyroid carcinoma[J].Thyroid,2010,20(8):863-871.[35] Shi X,Yu PC,Lei BW,et al.Association between programmed death-ligand 1 expression and clinicopathological characteristics, structural recurrence, and biochemical recurrence/persistent disease in medullary thyroid carcinoma[J].Thyroid,2019,29(9):1269-1278.[38] Ito Y,Onoda N,Ito KI,et al.Sorafenib in Japanese patients with locally advanced or metastatic medullary thyroid carcinoma and anaplastic thyroid carcinoma[J].Thyroid,2017,27(9):1142-1148.[39] Subbiah V,Gainor JF,Rahal R,et al.Precision targeted therapy with BLU-667 for RET-driven cancers[J].Cancer Discov,2018,8(7):836-849.[40] Subbiah V,Velcheti V,Tuch BB,et al. Selective RET kinase inhibition for patients with RET-altered cancers[J].Ann Oncol,2018,29(8):1869-1876.[41] Marchand L,Nozieres C,Walter T,et al.Combination chemotherapy with 5-fluorouracil and dacarbazine in advanced medullary thyroid cancer, a possible alternative?[J].Acta Oncol,2016,55(8):1064-1066.[42] Nocera M,Baudin E,Pellegriti G,et al.Treatment of advanced medullary thyroid cancer with an alternating combination of doxorubicin-streptozocin and 5 FU-dacarbazine[J].Br J Cancer,2000,83(6):715-718.[44] Maiza JC,Grunenwald S,Otal P,et al.Use of 131 I-MIBG therapy in MIBG-positive metastatic medullary thyroid carcinoma[J].Thyroid,2012,22(6):654-655.[45] Pasieka JL,Mcewan AJB,Rorstad O.The palliative role of 131I-MIBG and 111In-octreotide therapy in patients with metastatic progressive neuroendocrine neoplasms[J].Surgery,2004,136(6):1218-1226.[46] Satapathy S,Mittal BR,Sood A,et al.Efficacy and safety of concomitant 177 Lu-DOTATATE and low- dose capecitabine in advanced medullary thyroid carcinoma: a single-centre experience[J].Nucl Med Commun,2020,41(7):629-635.[48] Tuttle RM,Ganly I.Risk stratification in medullary thyroid cancer: Moving beyond static anatomic staging[J].Oral Oncol,2013,49(7):695-701.[49] Bihan H,Becker KL,Snider RH,et al.Calcitonin precursor levels in human medullary thyroid carcinoma[J].Thyroid,2003,13(8):819-822.[50] Walter MA,Meier C,Radimerski T,et al.Procalcitonin levels predict clinical course and progression-free survival in patients with medullary thyroid cancer[J].Cancer,2009,116(1):31-40.[51] Cupisti K,Wolf A,Raffel A,et al.Long-term clinical and biochemical follow-up in medullary thyroid carcinoma[J].Ann Surg,2007,246(5):815-821.[52] Miyauchi A,Onishi T,Morimoto S,et al.Relation of doubling time of plasma calcitonin levels to prognosis and recurrence of medullary thyroid carcinoma[J].Ann Surg,1984,199(4):461-466.[53] Laure Giraudet A,Al Ghulzan A,Auperin A,et al.Progression of medullary thyroid carcinoma: assessment with calcitonin and carcinoembryonic antigen doubling times[J].Eur J Endocrinol,2008,158(2):239.[54] Kukulska A,Krajewska J,Kolosza Z,et al.The role of postoperative adjuvant radiotherapy in the local control in medullary thyroid carcinoma[J].Endocr Connect,2020,9(1):1-8.
曹卫医生的科普号 2021年02月16日
2021年02月16日 2622
2622
 0
0
 0
0
-
一例甲状腺髓样癌
近期做了一例甲状腺髓样癌的患者,中年女性,查体发现甲状腺肿物,直径1.5厘米,FNA显示甲状腺髓样癌。 不得不说的是,随着医疗水平和技术的不断提高,我院病理科通过细胞学就可以初步诊断甲状腺髓样癌。 手术做了甲状腺全切+中央区淋巴结清扫+颈侧区淋巴结清扫术。 甲状腺髓样癌的发病率并不高,现将甲状腺髓样癌的特点总结一下: 甲状腺髓样癌medullary thyroid carcinoma,MTC 要症状 单侧或双侧甲状腺肿块,呼吸不畅、吞咽困难,颈侧区肿块,声音嘶哑,手足抽搐,类癌综合征 主要病因 RET原癌基因突变,遗传 多发群体 女性,且年龄在30~60岁之间,有MEN综合征家族史 甲状腺髓样癌实际上并非甲状腺癌,它来源于分泌降钙素的甲状腺滤泡旁细胞(又称C细胞),是神经内分泌细胞,和甲状腺滤泡细胞无关。1959年由Hazand等首先提出作为一个独立临床病理类型,它只占甲状腺肿瘤一小部分(约占3-12%),其发病、诊断和治疗都独具特点。 根据是否具有遗传性,MTC可分为散发性和遗传性两大类: 1.散发性MTC:临床上最多见,约占MTC的75- 80%,多为中老年,女性稍多; 2.遗传性MTC:临床上较少见,约占MTC的20- 25%,发病年龄较散发性MTC提前10-20年左右,男女发病率无差异,一个家族中可以同时或先后有多人患病。又细分为以下3种类型: 多发性内分泌腺瘤2A(MEN2A):占所有遗传性MTC80%,此型会同时发生MTC、嗜铬细胞瘤和甲状旁腺增生 多发性内分泌腺瘤2B(MEN2B):无甲状旁腺疾病,以粘膜多发性神经瘤伴MTC和(或)肾上腺嗜铬细胞瘤为特点,是遗传性MTC中恶性程度最高的类型; 家族非多发性内分泌腺瘤性MTC(FMTC):此型被认为是MEN2A的一种变异类型,MTC是其唯一的特征,是遗传性MTC中恶性程度最低的类型。 发病原因 1. MTC发病主要原因是RET原癌基因突变; 2. 约95%遗传性MTC和70%散发性MTC是由位于10q11.2原癌基因RET突变所致。 发病机制:主要发病机制为RET原癌基因突变后,导致甲状腺C细胞内外区蛋白构象的改变,进而诱导细胞增生过度而发生癌变。 临床表现 甲状腺髓样癌的临床表现: 1. 单侧或双侧甲状腺肿块:SMTC多表现为单发甲状腺肿瘤;遗传性MTC多表现双侧甲状腺多中心肿瘤; 2. 呼吸不畅、吞咽困难:为肿块大,压迫气管、食管所致; 3. 颈侧区肿块:为肿大的区域转移淋巴结,常见的转移部位有颈中央组及外侧淋巴结,临床医师可触及肿块的MTC患者,淋巴结转移率在75%以上; 4. 声音嘶哑:为肿瘤侵犯喉返神经所致; 5. 手足抽搐,为降钙素引起血钙降低所致; 6. 面部潮红、心悸、腹泻、消瘦等类癌综合征:在肝脏广泛转移病人中易见,为肿瘤细胞分泌的各种肽类及肽类激素所致; 7. 肝、肺、骨转移:肿瘤侵犯血管,发生远处转移,高达15%患者有远隔部位转移,为MTC病人主要死因。 治疗方法: 1. 目前手术是治疗MTC首选治疗方法; 2. 目前认为放、化疗只是在无效控制手段下作为姑息治疗方法; 3. 新型分子靶向治疗药物,用于晚期(转移性)MTC成年患者,安罗替尼就是一种选择; 4. 放射免疫治疗和接种疫苗治疗近期有所发展。 易患MTC疾病人群如下: 1. 女性,且年龄在30~60岁之间; 2. 有MEN综合征家族史:如患有甲状腺、甲状旁腺及肾上腺肿瘤疾病人群。 本人对此病的一些观点 1.一般看来,MTC患者血降钙素水平的升高与降低直接体现了病情的严重程度与变化,尤其是当医师将其作为术后患者是否能治愈的检测标准对其进行随访与监测时,大家更易被其表象所疑惑; 2.大量临床研究证实:如果您术后仍有持续性的血降钙素水平升高,但无临床触诊病灶和影像学检查复发证据(称为临床治愈患者),预后证明是好的,且与降钙素水平恢复正常的患者在5、10、15年生存率方面无明显差异,所以有以上情况的患者不必过度紧张。
 王永坤医生的科普号
王永坤医生的科普号 2021年01月26日
2021年01月26日 2873
2873
 0
0
 0
0
相关科普号

刘安阳医生的科普号
刘安阳 主治医师
北京清华长庚医院
甲状腺乳腺疝外科
5439粉丝381.1万阅读

刘跃武医生的科普号
刘跃武 主任医师
中国医学科学院北京协和医院
基本外科
6349粉丝70.8万阅读

曹卫医生的科普号
曹卫 主任医师
华中科技大学同济医学院附属协和医院
核医学科
5871粉丝99.2万阅读
-

 推荐热度5.0张平 副主任医师中国医大一院 甲状腺外科
推荐热度5.0张平 副主任医师中国医大一院 甲状腺外科甲状腺癌 618票
甲状腺瘤 239票
甲状腺疾病 11票
擅长:甲状腺及甲状旁腺外科疾病的诊断与治疗,精通甲状腺及甲状旁腺各种手术 -

 推荐热度4.7张帆 主任医师重庆市人民医院 乳腺甲状腺外科
推荐热度4.7张帆 主任医师重庆市人民医院 乳腺甲状腺外科甲状腺癌 519票
甲状腺瘤 205票
乳腺癌 116票
擅长:甲状腺癌、乳腺癌根治性手术,乳腺癌保留乳房和自体乳房重建术,规范应用甲状腺切除,中央区清扫及功能性颈廓清治疗甲状腺癌,娴熟掌握腔镜微创甲状腺手术,在多次术后复发和侵犯重要器官等复杂疑难甲状腺癌手术方面具有独到之处,开展肾衰后继发性甲旁亢的外科治疗 -

 推荐热度4.6彭小伟 主任医师湖南省肿瘤医院 甲状腺外科
推荐热度4.6彭小伟 主任医师湖南省肿瘤医院 甲状腺外科甲状腺癌 407票
甲状腺瘤 197票
甲状腺炎 2票
擅长:甲状腺结节、甲状腺癌的根治手术及规范性治疗,擅长不同路径的腔镜甲状腺手术。




